Butanalo
Aspekto
(Alidirektita el Butiraldehido)
| Buteraldehido | |||
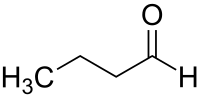 | |||
| Plata kemia strukturo de butanalo | |||
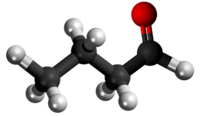 | |||
| Tridimensia kemia strukturo de butanalo | |||
| Alternativa(j) nomo(j) | |||
| |||
| Kemia formulo | |||
| CAS-numero-kodo | 123-72-8 | ||
| ChemSpider kodo | 256 | ||
| PubChem-kodo | 261 | ||
| Fizikaj proprecoj | |||
| Aspekto | senkolora likvaĵo kun penetranta odoro | ||
| Molmaso | 72,107 g·mol−1 | ||
| Denseco | 0,802g cm−3 | ||
| Fandpunkto | −96 °C[1] | ||
| Bolpunkto | 74,8 °C | ||
| Refrakta indico | 1,3766 | ||
| Ekflama temperaturo | −5 °C[2] | ||
| Memsparka temperaturo | 190 °C[3] | ||
| Solvebleco | Akvo:76 g/L | ||
| Mortiga dozo (LD50) | 2490 mg/kg (buŝe)[4] | ||
| Sekurecaj Indikoj | |||
| Riskoj | R11 | ||
| Sekureco | S9 S29 S33 | ||
| Pridanĝeraj indikoj | |||
| Danĝero
| |||
| GHS Damaĝo Piktogramo |
| ||
| GHS Signalvorto | Damaĝa substanco | ||
| GHS Deklaroj pri damaĝoj | H225, H319 | ||
| GHS Deklaroj pri antaŭgardoj | P210, P233, P240, P241, P242, P243, P280, P303+361+353, P370+378, P403+235, P501[5] | ||
(25 °C kaj 100 kPa) | |||
Butanalo aŭ buteraldehido, C4H8O, estas kemia kombinaĵo apartenanta al la funkcia grupo de la aldehidoj kaj izomero de la butanono. Ĝi estas senkolora likvaĵo kun penetranta odoro, uzata kiel analiza reakciaĵo en kemiaj sintezoj kaj en la fabrikado de farmaciaĵoj kaj kosmetikaĵoj. Butanalo estas solvebla en akvo, etanolo, duetila etero, acetono kaj kloroformo. Kiam ekspoziciita en aero ĝi oksidiĝas al buterata acido. Sub temperaturo superas al 230 °C, butanalo spontanee ekbrulas kun formado je eksplodemaj miksaĵoj.
Sintezoj
[redakti | redakti fonton]Sintezo 1
[redakti | redakti fonton]- Preparado per kataliza hidrogenigo de la buterata acido:
Sintezo 2
[redakti | redakti fonton]- Preparado per karboksiligo de la propano:
Sintezo 3
[redakti | redakti fonton]- Preparado per hidratigo de nitriloj en ĉeesto de zinko kaj klorida acido:
Sintezo 4
[redakti | redakti fonton]- Preparado per oksidigo de primara alkoholo:
Sintezo 5
[redakti | redakti fonton]- Konvertado de la 1-butanolo en ĉeesto de kloroformo kaj natria hidroksido:
Sintezo 6
[redakti | redakti fonton]- Preparado per reduktigo de esteroj:
Sintezo 7
[redakti | redakti fonton]- Preparado per reduktigo de acilaj kloridoj:
Reakcioj
[redakti | redakti fonton]Reakcio 1
[redakti | redakti fonton]- Reduktigo de aldehidoj:
Reakcio 2
[redakti | redakti fonton]- Preparado de la hidrokarbonido per reduktigo de aldehidoj:
Reakcio 3
[redakti | redakti fonton]- Konvertado de aldehidoj en karboksilataj acidoj:
Reakcio 4
[redakti | redakti fonton]- Reakcio kun tionila klorido:
Reakcio 5
[redakti | redakti fonton]- Reakcio kun acetila klorido:
Reakcio 6
[redakti | redakti fonton]- Konvertado de aldehidoj en amidoj:
Reakcio 7
[redakti | redakti fonton]- Senhidratigo de butanalo en ĉeesto de metanolo:
Literaturo
[redakti | redakti fonton]- The Good Scents Company
- Fisher Scientific
- Loba Chemie
- Encyclopedia of Chemical Processing and Design
- Handbook of Preservatives
- Patty's toxicology
- Industrial Chemistry: For Advanced Students
- Recent Developments in Catalysis: Theory and Practice







![{\displaystyle {\mathsf {{\xrightarrow[{-H_{2}O}]{2[H]}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a1c5c3deca84c3438595dcf3dbb607cece3b72b3)


![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a133815724e6bf6cfb39eb43f1e6c1d96ea8d17)




![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{-[H]}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ee5440517c815e645f453d79ea37136e0c4ae6a6)



![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{2[H]}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3e0bf23d773dd68c0756bf7219ac82b7a51e73c6)


![{\displaystyle {\mathsf {{\xrightarrow[{LiAlH_{4}}]{2[H]}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/454c2464d31e7672cf6ce87a8975c567c225cae5)
![{\displaystyle {\mathsf {{\xrightarrow[{-H_{2}O}]{4[H]}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a382c814aae1a28f9eacd23cc8d6d3e2d4298830)
![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{[O]}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/83ec2f57b9a299cd8e6bda67656e3c78132275b1)







![{\displaystyle {\mathsf {{\xrightarrow[{-H_{2}O}]{P_{2}O_{5}}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5c74b41fc228a01b384aecd43558f6c168421528)