Fosfora pentasulfido
Aspekto
(Alidirektita el P4S10)
| Fosfora pentasulfido | |||||
 | |||||
| Plata kemia strukturo de la Fosfora pentasulfido | |||||
 | |||||
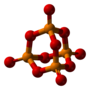
| Tridimensia kemia strukturo de la Fosfora pentasulfido | |||||
| Alternativa(j) nomo(j) | |||||
| |||||
| Kemia formulo | |||||
| CAS-numero-kodo | 1314-80-3 | ||||
| ChemSpider kodo | 14133 | ||||
| PubChem-kodo | 14817 | ||||
| Merck Index | 15,7466 | ||||
| Fizikaj proprecoj | |||||
| Aspekto | duonverde cindrokolora aŭ flava solidaĵo kun triklina strukturo | ||||
| Molmaso | 444,495 g·mol−1 | ||||
| Denseco | 2,09g cm−3 | ||||
| Fandpunkto | 286 °C[1] | ||||
| Bolpunkto | 513 °C | ||||
| Memsparka temperaturo | 142 °C[2] | ||||
| Solvebleco | Akvo:reakcias | ||||
| Mortiga dozo (LD50) | 389 mg/kg (buŝe) | ||||
| Sekurecaj Indikoj | |||||
| Riskoj | R11 R20/22 R29 R50 | ||||
| Sekureco | S2 S61 | ||||
| Pridanĝeraj indikoj | |||||
| Danĝero
| |||||
| GHS Damaĝo Piktogramo |
| ||||
| GHS Signalvorto | Damaĝa substanco | ||||
| GHS Deklaroj pri damaĝoj | H228, H260, H301, H301, H302, H311, H314, H318, H332, H400 | ||||
| GHS Deklaroj pri antaŭgardoj | P210, P223, P231+232, P240, P241, P260, P261, P264, P270, P271, P273, P280, P301+310, P301+312, P301+330+331, P302+352, P303+361+353, P304+312, P304+340, P305+351+338, P310, P311, P321, P330, P335+334, P361, P363, P370+378, P391, P402+404[3] | ||||
(25 °C kaj 100 kPa) | |||||
Fosfora pentasulfido aŭ P4S10 estas neorganika kombinaĵo de fosforo kaj sulfuro, duonverde cindrokolora aŭ flava solidaĵo kun triklina strukturo, ekzoterme reakcias kun akvo formante tiofosfatan acidon kaj sulfidan acidon. Ĝi estas solvebla en solvaĵoj de alkalaj hidroksidoj, karbona dusulfido, reakcias kun alkoholoj kaj acidoj. Ĝi ankaŭ estas krudmaterialo en la fabrikado de pesticidoj kaj insekticidoj. Kiam varmigita ĝi eligas toksajn gasojn. Fosfora pentasulfido estas uzata en la sintezo de Gabriel, kiu konvertas primarajn alkilajn halogenidojn en primarajn aminojn. Ĉi-reakcio estis malkovrita de Siegmund Gabriel (1851-1924) en la jaro 1910.
Sintezoj
[redakti | redakti fonton]Sintezo 1
[redakti | redakti fonton]Reakcioj
[redakti | redakti fonton]Reakcio 1
[redakti | redakti fonton]- Fosfora pentasulfido reakcias kun alkoholoj produktante tioalkoholojn aŭ sulfuralkoholojn. Ekzemple: Kun metanolo ĝi donas tiometanolon:
Reakcio 2
[redakti | redakti fonton]- Ĝi reakcias kun fosfora kvinklorido por formi tiofosforilan kloridon
Reakcio 3
[redakti | redakti fonton]- Dufosfora pentasulfido reakcias kun amoniako por doni trifosforan pentanitridon:
Reakcio 4
[redakti | redakti fonton]- Hidrolizo de dufosfora pentasulfido donas tiofosfatan acidon kaj sulfidan acidon:
Reakcio 5
[redakti | redakti fonton]- Dufosfora pentasulfido reakcias kun 16 moloj da natria hidroksido por formi natrian dutiofosfaton, natrian sulfidon kaj akvon sub temperaturo 50 °C:
Reakcio 6
[redakti | redakti fonton]- Dufosfora pentasulfido reakcias kun 24 moloj da natria hidroksido por formi natrian tiofosfaton, natrian sulfidon kaj akvon sub temperaturo 70 °C:
Literaturo
[redakti | redakti fonton]- The Essential Chemical Industry
- Microkat
- A Guide to Organophosphorus Chemistry
- Science of Synthesis Knowledge
- A Comprehensive Guide to the Hazardous Properties of Chemical Substances
- Handbook of Chalcogen Chemistry: New Perspectives in Sulfur, Selenium and Tellurium









![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a133815724e6bf6cfb39eb43f1e6c1d96ea8d17)

![{\displaystyle {\mathsf {{\xrightarrow[{}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/af21b07e9e503bdbbee6814c136975f68f374663)

![{\displaystyle {\mathsf {{\xrightarrow[{}]{105^{o}C-200^{o}C}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5ae0cb7c453640f66171354588d89d4661f7da64)
![{\displaystyle {\mathsf {{\xrightarrow[{}]{230^{o}C-600^{o}C}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c438298cbb60958c5264d7e1434ef4af6273eb80)

![{\displaystyle {\mathsf {{\xrightarrow[{}]{50^{o}C}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0c355df0665b87cbd849119b03c9de88932a418d)
![{\displaystyle {\mathsf {{\xrightarrow[{}]{70^{o}C}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f7dbbe2ecc765026a9d3688a7ac634ce17304522)