Amonia citrato tribaza
Aspekto
| Amonia citrato tribaza | ||
 | ||
| Plata kemia strukturo de la Amonia citrato | ||
 | ||
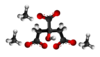
| Tridimensia kemia strukturo de la Amonia citrato | ||
| Kemia formulo | ||
| CAS-numero-kodo | 3458-72-8 | |
| ChemSpider kodo | 17896 | |
| PubChem-kodo | 18954 | |
| Fizikaj proprecoj | ||
| Aspekto | travideblaj kristaloj | |
| Molmaso | 243,216 g·mol-1 | |
| Denseco | 1,48g cm−3 | |
| Fandpunkto | 185°C[1] | |
| Solvebleco | Akvo:Tute solvebla | |
| Mortiga dozo (LD50) | 350 mg/kg (buŝe) | |
| Sekurecaj Indikoj | ||
| Riskoj | 26-37-60 | |
| Sekureco | 37|38 | |
| Pridanĝeraj indikoj | ||
| Danĝero
| ||
| GHS Damaĝo Piktogramo |
| |
| GHS Signalvorto | Averto | |
| GHS Deklaroj pri damaĝoj | H315, H319, H335 | |
| GHS Deklaroj pri antaŭgardoj | P261, P264, P271, P280, P302+352, P304+340, P305+351+338, P321, P332+313, P337+313, P362, P403+233, P405, P501[2] | |
(25 °C kaj 100 kPa) | ||
Triamonia citrato aŭ C6H17N3O7 estas kemia kombinaĵo, blankaj aŭ travideblaj kristaloj solveblaj en akvo, malpli solveblaj en etanolo kaj etero kaj neakordigebla kun oksidigaj agentoj. Ĝi uzatas kiel antioksidiga nutrosuplemento kies komerca kodo estas E380 kaj estas rezultanta el interagado de la citrata acido kaj amonia hidroksido. Per varmigo ĝi malkomponiĝas en citrata acido kaj amoniako. Ĝiaj solvaĵoj estas forte alkalaj.
Sintezoj
[redakti | redakti fonton]Sintezo 1
[redakti | redakti fonton]- Preparado per agado de citrata acido kaj amonia hidroksido:
Sintezo 2
[redakti | redakti fonton]- Preparado per traktado de citrata acido kaj amonia acetato:
Sintezo 3
[redakti | redakti fonton]- Preparado per reakcio de propanoata acido kaj amonia karbonato:
Sintezo 4
[redakti | redakti fonton]Sintezo 5
[redakti | redakti fonton]- Preparado per interagado de metila citrato kaj amonia formiato:
Sintezo 6
[redakti | redakti fonton]- Preparado per acida transesterigo inter citrata acido kaj amonia benzoato:
Sintezo 7
[redakti | redakti fonton]- Preparado per alkohola transesterigo inter metila citrato kaj amonia hidroksido:
Reakcioj
[redakti | redakti fonton]Reakcio 1
[redakti | redakti fonton]- Hidrolizo de la amonia citrato:
Reakcio 2
[redakti | redakti fonton]- Reakcio kun sulfata acido:
Reakcio 3
[redakti | redakti fonton]- Reakcio per acida transesterigo kun formiata acido:
Reakcio 4
[redakti | redakti fonton]- Reakcio per alkohola transesterigo kun metila alkoholo:
Reakcio 5
[redakti | redakti fonton]- Reakcio kun dumetila karbonato:
Reakcio 6
[redakti | redakti fonton]- Reakcio kun HNO3:
Reakcio 7
[redakti | redakti fonton]- Reakcio kun HCl:
Vidu ankaŭ
[redakti | redakti fonton]Literaturo
[redakti | redakti fonton]- Sigma Aldrich
- Studies on the Barium Citrate Complex in Ammonium Chloride by the Ion ...
- Food Additives Data Book
- Organic Chemistry
- Handbook of Mineral Elements in Food
- Handbook of Water Analysis
- The Pharmacist
- Food Additives in Europe 2000: Status of Safety Assessments of Food ...




![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a133815724e6bf6cfb39eb43f1e6c1d96ea8d17)