Etanosulfinata acido
| Etanosulfinata acido | ||
 | ||
Etanosulfinata acido | ||
 | ||
| Alternativa(j) nomo(j) | ||
| ||
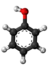
| Kemia formulo | ||
| CAS-numero-kodo | 598-59-4 | |
| ChemSpider kodo | 385143 | |
| PubChem-kodo | 435496 | |
| Fizikaj proprecoj | ||
| Molmaso | 94,128 g mol−1 | |
| Denseco | 1,398g/cm−3 | |
| Bolpunkto | 244 °C | |
| Refrakta indico | 1,546 | |
| Ekflama temperaturo | 101,4 °C | |
| Solvebleco | Akvo:reakcias | |
| Mortiga dozo (LD50) | 580 mg/kg (buŝe) | |
| GHS etikedigo de kemiaĵoj | ||
| GHS Damaĝo-piktogramo |
| |
| GHS Signalvorto | Danĝera | |
| GHS Deklaroj pri damaĝoj | H314 | |
| GHS Deklaroj pri antaŭgardoj | P260, P264, P280, P301+330+331, P303+361+353, P304+340, P305+351+338, P310, P321, P363, P405, P501 | |
(25 °C kaj 100 kPa) | ||
Etanosulfinata acido estas organosulfura kombinaĵo kaj deirpunkto por sennombraj derivaĵoj uzataj en kemiaj sintezoj kaj industrio. Ĝenerale la natriaj saloj de la etanosulfinataj acidoj estas pli stabilaj ol la acida formo. Etanosulfinataj acidoj estas pli acidaj ol la korespondaj karboksilataj acidoj. Ofte la etanosulfinataj acidoj estas produktataj el la korespondaj saloj kiuj estas facile troveblaj.
Etanosulfinata acido estas neakordigebla kun aminoj, bazoj, akvo kaj ordinaraj metaloj. Ĝi liberigas konsiderindan varmamason kiam diluita kun akvo. Ĝi estas koroda substanco kaj malkomponiĝas sub varmagado ellasante karbonaj oksidoj kaj sulfuraj oksidoj. Etanosulfinata acido estas krudmaterialo uzata en medicino kaj kiel pesticido.
Ĝi ankaŭ povas esti uzata kiel senhidratiga agento, sekiga akcelilo por tegaĵo, traktanta agento por fibro, solvanto, katalizilo kaj esterigo same kiel en polimerigaj reakcioj. Ĝi povas esti uzata por alkilado, katalizilo de esteriĝo kaj polimerigo, ankaŭ uzata en medicino. kaj galvanoplastika industrio. Ĝi ankaŭ povas esti aplikita al oksigenado.
Sintezoj
[redakti | redakti fonton]Sintezo 1
[redakti | redakti fonton]- Preparado per traktado de etano kaj sulfura duoksido. Ĉi-reakcio ilustras aromatan sulfinigon, kiu konsideratas "unu el la plej gravaj en industria organika kemio".:
Sintezo 2
[redakti | redakti fonton]- Preparado per traktado de etanosulfinila klorido kaj natria hidroksido:
Sintezo 3
[redakti | redakti fonton]- Preparado per traktado de etanosulfinila klorido kaj zinka hidroksido:
Sintezo 4
[redakti | redakti fonton]- Preparado per reduktado de etanosulfinila klorido kun natria sulfito en akva medio:
Sintezo 5
[redakti | redakti fonton]- Preparado per traktado de natria etanosulfinato kaj klorida acido:
Sintezo 6
[redakti | redakti fonton]- Preparado per interagado de etano kun sulfita acido:
Sintezo 7
[redakti | redakti fonton]- Preparado per traktado de etano kun tionila klorido:
Reakcioj
[redakti | redakti fonton]Reakcio 1
[redakti | redakti fonton]- Sapigo de la etanosulfinata acido
Reakcio 2
[redakti | redakti fonton]- Esterigo de la etanosulfinata acido:
Reakcio 3
[redakti | redakti fonton]- Preparado de "etanosulfinamido" per amonolizo de la etanosulfinata acido:
Reakcio 4
[redakti | redakti fonton]- Preparado de klorosulfinata acido per traktado de etanosulfinata acido kun kloro:
Reakcio 5
[redakti | redakti fonton]- Reakcio kun kloramino:
Reakcio 6
[redakti | redakti fonton]- Reakcio kun sodamido en acida medio:
Reakcio 7
[redakti | redakti fonton]- Reakcio kun nitrozila klorido:



![{\displaystyle {\mathsf {{\xrightarrow[{}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/af21b07e9e503bdbbee6814c136975f68f374663)




![{\displaystyle {\mathsf {{\xrightarrow[{-\;H_{2}O}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/62924f62b8dd2b05f80404f46e215209bda155c9)
![{\displaystyle {\mathsf {{\xrightarrow[{-\;HCl}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b9dba2fec3ed5be5edc819a4d2f1fa984d913593)

![{\displaystyle {\mathsf {{\xrightarrow[{}]{+[H]}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/88fb0b03b975cfe42ff07b526c4bddf66812655c)

![{\displaystyle {\mathsf {{\xrightarrow[{}]{[OH]^{-}}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/258ce3c08df9dce17beda55311dbfb79464c8a40)