Sulfura diklorido
Aspekto
| Sulfura duklorido | ||||
 | ||||
| Plata kemia strukturo de la Sulfura diklorido | ||||
 | ||||
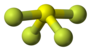
| Tridimensia kemia strukturo de la Sulfura diklorido | ||||
| Kemia formulo | ||||
| CAS-numero-kodo | 10545-99-0 | |||
| ChemSpider kodo | 23682 | |||
| PubChem-kodo | 25353 | |||
| Fizikaj proprecoj | ||||
| Aspekto | ruĝa likvaĵo kun penetranta odoro | |||
| Molmaso | 102,96 g·mol−1 | |||
| Denseco | 1,621g cm−3 | |||
| Fandpunkto | −76 °C | |||
| Bolpunkto | 59,5 °C (malkomponiĝas) | |||
| Refrakta indico | 1,5575 | |||
| Ekflama temperaturo | 130 °C | |||
| Memsparka temperaturo | 390 °C | |||
| Solvebleco | Akvo:reakcias | |||
| Mortiga dozo (LD50) | 132 mg/kg (buŝe)[1] | |||
| Sekurecaj Indikoj | ||||
| Riskoj | R14 R34 R37 R50 | |||
| Sekureco | S26 S45 S61 | |||
| Pridanĝeraj indikoj | ||||
| Danĝero
| ||||
| GHS Damaĝo Piktogramo |
| |||
| GHS Signalvorto | Damaĝa substanco | |||
| GHS Deklaroj pri damaĝoj | H314, H335, H400 | |||
| GHS Deklaroj pri antaŭgardoj | P260, P261, P264, P271, P273, P280, P301+330+331, P303+361+353, P304+340, P305+351+338, P310, P321, P363, P391, P403+233, P405, P501[2] | |||
(25 °C kaj 100 kPa) | ||||
Sulfura diklorido aŭ sulfura duklorido (molekula formulo SCl2) estas kemia sulfura kombinaĵo de kloro, ruĝa likvaĵo kun penetranta odoro, uzata kiel antaŭaĵo al organosulfuraj komponaĵoj. Disulfura diklorido aŭ S2Cl2 estas la plej ordinara malpuraĵo en la produktado de SCl2. Apartigo de SCl2 elde S2Cl2 eblas per distilado kun PCl3 por formi azeotropan miksaĵon kun 99% da pureco. Tamen, sulfura diklorido perdas kloron malrapide sub meditemperaturo kaj retroiĝas al disulfura diklorido. Puraj specimenoj povas esti stokigitaj en vitraj ampoloj, kiuj disvolvas ioman pozitivan klorpremon, haltigante malkomponadon.
Sintezoj
[redakti | redakti fonton]Sintezo 1
[redakti | redakti fonton]Sintezo 2
[redakti | redakti fonton]- Preparado per traktado de sulfuro kaj sulfurila klorido:
Sintezo 3
[redakti | redakti fonton]- Unusulfura duklorido ankaŭ prepareblas per reakcio inter disulfura diklorido kaj kloro:
Reakcioj
[redakti | redakti fonton]Reakcio 1
[redakti | redakti fonton]Reakcio 2
[redakti | redakti fonton]Reakcio 3
[redakti | redakti fonton]- Ĝi reakcias kun nitrata acido donante sulfatan acidon, nitrogenan dioksidon kaj kloridan acidon:
Reakcio 4
[redakti | redakti fonton]- Kun natria hidroksido ĝi donas natrian sulfiton, natrian kloridon, sulfuron kaj akvon:
Reakcio 5
[redakti | redakti fonton]- Kun oksigeno ĝi donas sulfurilan kloridon:
Reakcio 6
[redakti | redakti fonton]- Duklorido de sulfuro reakcias kun kloro por doni sulfuran tetrakloridon:
Reakcio 7
[redakti | redakti fonton]- Unusulfura klorido reakcias kun natria fluorido formante sulfuran tetrafluoridon, disulfuran dikloridon kaj natrian kloridon:
Literaturo
[redakti | redakti fonton]- Science of Synthesis: Houben-Weyl Methods of Molecular Transformations
- Organic Sulfur Compounds
- Synthetic Methods of Organometallic and Inorganic Chemistry
- Seven-Membered Heterocyclic Compounds Containing Oxygen and Sulfur
- Advances in Heterocyclic Chemistry
- Io After Galileo: A New View of Jupiter's Volcanic Moon







![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{240^{o}C}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/818883c73e8a685f34f0eed6524164ace50bab82)

![{\displaystyle {\mathsf {{\xrightarrow[{}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/af21b07e9e503bdbbee6814c136975f68f374663)
![{\displaystyle {\mathsf {{\xrightarrow[{FeCl_{3}}]{20^{o}C}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/082189387f04720225d429a50d47ddc62a13c55a)
![{\displaystyle {\mathsf {{\xrightarrow[{}]{70^{o}C}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f7dbbe2ecc765026a9d3688a7ac634ce17304522)

![{\displaystyle {\mathsf {{\xrightarrow[{}]{90^{o}C}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6fd2f31566666c7ce4363187676275345d93979a)