Sulfura tetrafluorido
| Sulfura tetrafluorido | |||||
 | |||||
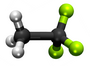
| Plata kemia strukturo de la Sulfura tetrafluorido | |||||
 | |||||
| Tridimensia kemia strukturo de la Sulfura tetrafluorido | |||||
| Alternativa(j) nomo(j) | |||||
| |||||
| Kemia formulo | |||||
| CAS-numero-kodo | 7783-60-0 | ||||
| ChemSpider kodo | 22961 | ||||
| PubChem-kodo | 24555 | ||||
| Merck Index | 15,9108 | ||||
| Fizikaj proprecoj | |||||
| Aspekto | senkolora, toksa kaj koroda gaso kun odoro simila al sulfura duoksido | ||||
| Molmaso | 108,054 g·mol-1 | ||||
| Denseco | 1,95g cm−3 | ||||
| Fandpunkto | -121°C | ||||
| Bolpunkto | -38°C[1] | ||||
| Solvebleco | Akvo:reakcias | ||||
| Mortiga dozo (LD50) | 320 mg/kg (buŝe) | ||||
| Sekurecaj Indikoj | |||||
| Riskoj | R26 R35 | ||||
| Sekureco | S9 S26 S36/37/39 S45 | ||||
| Pridanĝeraj indikoj | |||||
| Danĝero
| |||||
| GHS Damaĝo Piktogramo |
| ||||
| GHS Signalvorto | Damaĝa substanco | ||||
| GHS Deklaroj pri damaĝoj | H280, H314, H318, H330, H335, H370, H372, H373 | ||||
| GHS Deklaroj pri antaŭgardoj | P260, P261, P264, P270, P271, P280, P284, P301+330+331, P303+361+353, P304+340, P305+351+338, P310, P314, P320, P321, P363, P403+233, P405, P410+403, P501[2] | ||||
(25 °C kaj 100 kPa) | |||||
Sulfura tetrafluorido aŭ SF4 estas esta neorganika sulfura komponaĵo, senkolora, toksa,reakciema kaj koroda gaso kun odoro simila al sulfura duoksido, uzata kiel reakcianto en la preparado de organofluoraj kombinaĵoj, kaj en farmaciaj kaj en kemiaj industrioj. Sulfura tetrafluorido liberigas kloridan acidon kaj tionilan fluoridon kiam ekspoziciata al humideco kaj kaŭzas brulvundojn sur neprotektitaj haŭtoj.
En organikaj sintezoj, SF4 estas uzata por konverti COH-grupojn al C=O-grupoj, kaj CF al CF2 grupoj respektive. Certaj alkoholoj donas la korespondan fluorokarbonon. Ketonoj kaj aldehidoj donas najbarajn dufluoridojn. Karboksilataj acidoj konvertiĝas al trifluorometilaj derivaĵoj. Ekzemple: Acetata acido kun SF4 produktas 1,1,1-trifluoro-etanon.
Sintezoj
[redakti | redakti fonton]Sintezo 1
[redakti | redakti fonton]- Preparado per interagado de sulfuro kaj kobalta trifluorido:
Sintezo 2
[redakti | redakti fonton]- Preparado per reakcio inter sulfura duklorido kaj natria fluorido:[3]
Sintezo 3
[redakti | redakti fonton]- Preparado per traktado de sulfura duklorido, natria fluorido kaj klorgaso:[4]
Sintezo 4
[redakti | redakti fonton]- Sulfura tetrafluorido estiĝas per agado de kalia fluorido sur sulfura tetraklorido:
Reakcioj
[redakti | redakti fonton]Reakcio 1
[redakti | redakti fonton]- Preparado de tionila fluorido per interagado de sulfura tetrafluorido kaj akvo:
Reakcio 2
[redakti | redakti fonton]- Hidrolizo de sulfura tetrafluorido donante sulfuran dioksidon kaj fluoridan acidon:
Reakcio 3
[redakti | redakti fonton]- Sulfura tetrafluorido reakcias kun joda pentaoksido por formi jodan pentafluoridon kaj tionilan fluoridon:
Reakcio 4
[redakti | redakti fonton]- Preparado de bora trifluorido per reakcio de sulfura tetrafluorido kun bora triklorido
Reakcio 5
[redakti | redakti fonton]- Preparado de sulfata acido per interagado de sulfura tetrafluorido kaj nitrata acido:
Reakcio 6
[redakti | redakti fonton]- Sintezo de natria sulfito kaj natria fluorido per interagado de sulfura tetrafluorido kaj natria hidroksido:
Reakcio 7
[redakti | redakti fonton]- Sulfura tetrafluorido reakcias kun acetata acido por formi 1,1,1-trifluoron-etanon, sulfuran duoksidon kaj fluoridan acidon:
Literaturo
[redakti | redakti fonton]- Synquest Laboratories Arkivigite je 2018-12-03 per la retarkivo Wayback Machine
- Chemical Book
- Med Tech
- Houben-Weyl Methods of Organic Chemistry
- Chemistry, Structure and Dynamics Arkivigite je 2018-12-03 per la retarkivo Wayback Machine
- Sulfur Extrusion Reactions: Scope And Mechanistic Aspects
Referencoj
[redakti | redakti fonton]- ↑ World of Chemicals. Arkivita el la originalo je 2018-12-03. Alirita 2018-12-02 .
- ↑ PubChem
- ↑ Houben-Weyl Methods of Organic Chemistry
- ↑ Inorganic Chemistry








![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a133815724e6bf6cfb39eb43f1e6c1d96ea8d17)


![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{300^{o}C}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2c855a36befd9a343b9682d6f26079938054865c)


![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{-40^{o}C}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/be95871df969d08ac12d10a90b8c654e88128b9b)


![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{90^{o}C}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eb70d4493bf7e8fc974062929320aa29c7c423ae)



![{\displaystyle {\mathsf {{\xrightarrow[{}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/af21b07e9e503bdbbee6814c136975f68f374663)