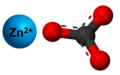
Zinka karbonato
Aspekto
| Zinka karbonato | ||
| Kemia formulo | ||
 | ||
zinka karbonato | ||
 | ||
 | ||
| Smitsonito, rara erco de zinka karbonato, kiu ricevis tian nomon en 1832 omaĝe al la mineralogo James Smithson (1765–1829), patrono de la Smitsona Instituto.[1] | ||
| Alternativa(j) nomo(j) | ||
| ||
| CAS-numero-kodo | 3486-35-9 | |
| ChemSpider kodo | 17943 | |
| PubChem-kodo | 19005 | |
| Fizikaj proprecoj | ||
| Aspekto | blanka, nebrulema, senodora solidaĵo | |
| Molmaso | 125,388g mol−1 | |
| Denseco | 4,398 g/cm−3[2] | |
| Bolpunkto | 333,6°C [3][4] | |
| Ekflama temperaturo | 169,8°C [5][6] | |
| Solvebleco | Akvo:0,001 g/L | |
| Mortiga dozo (LD50) | >2000 mg/kg (buŝe) [7][8] | |
| GHS etikedigo de kemiaĵoj | ||
| GHS Damaĝo Piktogramo |
| |
| GHS Signalvorto | Averto | |
| GHS Deklaroj pri damaĝoj | H400, H410, H411, H413 | |
| GHS Deklaroj pri antaŭgardoj | P273, P391, P501 | |
(25 °C kaj 100 kPa) | ||
Zinka karbonato [kies molekula formulo estas ZnCO3] estas blanka, nebrulema, senodora kaj sengusta solidaĵo, nesolvebla en akvo kaj etanolo, kaj nature trovata tiel kiel la mineralo smitsonito. Zinka karbonato estas solvebla en amoniako kaj prepareblas per traktado de malvarmaj solvaĵoj de zinka sulfato kun kalia bikarbonato. Per varmigado ĝi iĝas en bazan zinkan karbonaton aŭ (Zn5(CO3)2(OH)6). Ĝi estas solvebla en diluitaj acidoj kaj natria hidroksido. Per 30% da hidrogena peroksido ĝi liberigas karbonan duoksidon kaj iĝas en peroksido.
Reakcioj
[redakti | redakti fonton]Reakcio 1
[redakti | redakti fonton]- Preparado de zinka karbonato per traktado de natria karbonato kun zinka nitrato:
Reakcio 2
[redakti | redakti fonton]- Preparado de zinka karbonato per traktado de kalia bikarbonato kun zinka sulfato:
Reakcio 3
[redakti | redakti fonton]- Preparado de zinka karbonato per traktado de karbona duoksido kun zinka oksido:
Reakcio 4
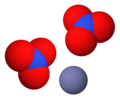
[redakti | redakti fonton]- Preparado de zinka karbonato per traktado de karbona duoksido kun zinka klorido:



![{\displaystyle {\mathsf {{\xrightarrow[{}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/af21b07e9e503bdbbee6814c136975f68f374663)