Azolo
| Ĉi tiu artikolo temas pri klaso de kemia kombinaĵo. Por genro de plantoj "Azolla" rigardu la paĝon Azolo (planto). |

Azolo[1] estas klaso de aromataj kvinmembraj ciklaj kombinaĵoj (kaj kun malmultaj esceptoj heterociklaj kombinaĵoj) enhavantaj kiel parto de la ringo nitrogenatomon, kaj aldone minimume unu plian ne-karbonan atomon, kiu povas esti aŭ plia nitrogeno, aŭ sulfuro aŭ oksigeno. Ilia nomo derivas el la nomenklaturo kreita de Arthur Rudolf Hantzsch (1857-1935) kaj Oskar Widman (1852-1930). La bazaj komponaĵoj estas aromataj kaj posedas du duoblajn ligilojn. Kelkaj reduktitaj analogaĵoj ankaŭ sintezeblas tiaj kiaj la azolino kaj azolidino.
Unu, kaj nur unu soleca elektroparo en ĉiu heteroatomo de la ringo partoprenas en la aromata ligaĵo de unu azolo. La nomoj de la azoloj konservas la prefikson okaze de la reduktiĝo (ekzemple: pirazolino, pirazolidino, ktp). La nombrado de la ringatomoj en la azoloj komencas per la heteroatomo kiu ne partoprenas en la duobla ligilo, kaj poste daŭrigas rilate al la alia heteroatomo. Imidazolo kaj aliaj heterociklaj aromataj kvin-membraj sistemoj kun du nitrogenoj estas ekstreme ordinaraj en naturo kaj estas parto de kernoj de multaj biomolekuloj, tia kia la histidino.
Iom da historio
[redakti | redakti fonton]Ĝis la 1940-jardeko, relative malmultaj agentoj estis disponeblaj por la traktado de sistemaj fungaj infektoj. La disvolvado de la polienaj antifungaĵoj reprezentis pli grandan avancon en la medicina mikologio. Kvankam la amfotericino B rapide iĝis la ĉefa terapia vojo por la seriozaj infektoj, ĝia uzo asociiĝis al infuzo-rilataj kromefektoj kaj dozo-limiga nefrotokseco.
La esploristoj plu serĉis malpli toksajn antifungaĵojn kaj tiuj studoj rezultis en la malkovro de la azoloj post pluraj jardekoj. Ketokonazolo (1981), la unua disponebla komponaĵo por buŝtraktado de sistemaj fungaj infektoj, estis sintezita en la komenco de la 1980-jardeko.
Dum preskaŭ unu jardeko, ketokonazolo estis konsiderata la prefera drogo por la nevivominacaj endemiaj mikozoj. La enkonduko de la unua-generaciaj triazoloj reprezentis pli grandan avancon por traktado de fungaj malsanoj. Kaj flukonazolo (1990) kaj itrakonazolo (1992) elmontris pli grandan spektron pri antifunga aktiveco ol la tiamaj imidazoloj kaj havis rimarkeble plibonigitan sekurecoprofilon kun la amfotericino B kaj ketokonazolo.
Malgraŭ la ĝeneraligita uzo, ĉi-agentoj iĝis subigitaj al sennombraj klinike gravaj limigaĵoj rilate al ilia nekontentiga aktiveco-spektro, rezisto-disvolvado, induktado al damaĝaj interdrogaj interagadoj, ilia nekompleta farmako-kinetika profilo (kapsuloj de itrakonazolo) kaj tokseco.
Celante venki tiajn limigojn, pluraj analogaĵoj estis disvolvitaj. La tiam-nomataj dua-generaciaj triazoloj, inklude de vorikonazolo[2], pozakonazolo[3] kaj ravukonazolo[4] havis pli grandan potencon kaj posedis plejgrandan aktivecon kontraŭ rezistaj emerĝaj patogenoj, aparte kontraŭ la aspergiloj. Se la tokseco-profilo de tiuj agentoj kompareblas aŭ plibonigeblas al tiuj el la unua-generaciaj triazoloj kaj la drogo-interagado restas administreblaj, tiam ĉi-komponaĵoj reprezentas veran ekspansion de la antifunga arsenalo.[5]
Klasado de la azoloj
[redakti | redakti fonton]Laŭ la nombro de la heteroatomoj, la azoloj klasiĝas en:
- azoloj (kun unu nitrogenatomo): Pirolo
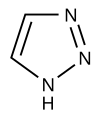
- duazoloj (kun du nitrogenatomoj): pirazolo, imidazolo
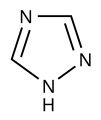
- triazoloj (kun tri nitrogenatomoj): triazolo
- kvarazoloj (kun kvar nitrogenatomoj): kvarazolo
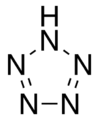
- kvinazoloj (kun kvin nitrogenatomoj): kvinazolo
- oksoloj aŭ furanoj (kun unu oksigenatomo)
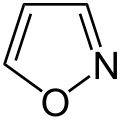
- oksazoloj kaj isooksazoloj (kun unu nitrogeatomo kaj unu oksigenatomo)
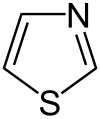
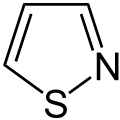
- tiazoloj kaj izotiazoloj (kun unu nitrogeatomo kaj unu sulfuratomo)
- duoksoloj aŭ dufuranoj (kun du oksigenatomoj)
Tipe azolaj strukturoj
[redakti | redakti fonton]Azoloj nurnitrogenaj
[redakti | redakti fonton]Azoloj kun nitrogenatomoj kaj oksigenatomoj
[redakti | redakti fonton]-
1,2,3-oksaduazolo
(malstabila) -
Oksaduazolo
(1,2,4-Oksaduazolo) -
Furazano
(1,2,5-oksaduazolo) -
1,3,4-oksaduazolo
Azoloj kun nitrogenatomoj kaj sulfuratomoj
[redakti | redakti fonton]-
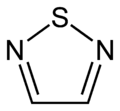
Tiadiazolo
(1,2,3-Tiaduazolo) -
1,2,4-tiaduazolo
-
1,2,5-tiaduazolo
-
1,3,4-tiaduazolo
Literaturo
[redakti | redakti fonton]- Drugs.com
- UpToDate
- Citizendium
- Chemical Book
- Educatio Arkivigite je 2017-04-25 per la retarkivo Wayback Machine
- Clinical Mycology, William E. Dismukes, Peter G. Pappas, Jack D. Sobel
Kunrilataj kemiaĵoj
[redakti | redakti fonton]-
Sulfanilamido
-
Flukonazolo
-
Ketokonazolo
-
Itrakonazolo
-
Pozakonazolo
-
Ravukonazolo
-
Vorikonazolo
Vidu ankaŭ
[redakti | redakti fonton]- Benzoizotiazolo
- Benzotriazolo
- Izotiazino
- Izotiazolinono
- Izotiazolo
- Metil-izotiazolinono
- Oksazolo
- Pirazolo
- Tiazino
- Tiazolidino
- Tiazolinono
- Tiazolo
- Heinrich Houben (1875-1940)
- Theodor Weyl (1851-1913)
Referencoj
[redakti | redakti fonton]- ↑ English-Esperanto Chemical Dictionary, Dr. D. R. Duncan, Brita Esperanto Asocio
- ↑ Drug Interactions in Infectious Diseases Stephen C. Piscitelli, Keith A. Rodvold
- ↑ Kucers' The Use of Antibiotics Sixth Edition: A Clinical Review of ..., M Lindsay Grayson, Suzanne M Crowe, James S McCarthy, John Mills, Johan W Mouton, S Ragnar Norrby, David L Paterson, Michael A Pfaller
- ↑ Annual Reports in Medicinal Chemistry, Volume 41
- ↑ Wiley Online Library