Fosforila fluorido
| Fosforila fluorido | |||
 | |||
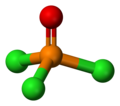
| Plata kemia strukturo de la Fosforila fluorido | |||
 | |||
| Tridimensia kemia strukturo de la Fosforila fluorido | |||
| Alternativa(j) nomo(j) | |||
| |||
| Kemia formulo | |||
| CAS-numero-kodo | 13478-20-1 | ||
| ChemSpider kodo | 75351 | ||
| PubChem-kodo | 83516 | ||
| Fizikaj proprecoj | |||
| Aspekto | senkolora, venena, koroda gaso | ||
| Molmaso | 103,968 g·mol−1 | ||
| Denseco | 4,25g cm−3[1] | ||
| Fandpunkto | −68 °C | ||
| Bolpunkto | −39,7 °C | ||
| Solvebleco | Akvo:reakcias | ||
| Mortiga dozo (LD50) | 5 mg/kg (buŝe) | ||
| Sekurecaj Indikoj | |||
| Riskoj | R14 R34 R36/37/38 [2] | ||
| Sekureco | S1/2 S7/9 S26 S36/37/39 S45 | ||
| Pridanĝeraj indikoj | |||
| Danĝero
| |||
| GHS Damaĝo Piktogramo |
| ||
| GHS Signalvorto | Damaĝa substanco | ||
| GHS Deklaroj pri damaĝoj | H290, H300, H302, H311, H314, H318, H330, H372 | ||
| GHS Deklaroj pri antaŭgardoj | P234, P260, P264, P270, P271, P280, P284, P301+310, P301+312, P301+330+331, P302+352, P303+361+353, P304+340, P305+351+338, P310, P314, P320, P321, P330, P361, P363, P403+233, P404, P405, P501 | ||
(25 °C kaj 100 kPa) | |||
Fosforila fluorido aŭ POF3 estas neorganika fosfora kombinaĵo, senkolora, venena, koroda gaso, analogaĵo de la fosforila klorido kaj fosforila bromido, uzata kiel kemia reakcianto en industriaj kaj laboratoriaj sintezoj. Ĝi reakcias kun akvo formante fluoridan acidon kaj fosfatan acidon.
Ekzistas multaj manieroj por produkti ĉi-substancon. Thomas Edward Thorpe (1845-1925) kaj F. J. Hambly uzis la reakcion de kriolito kaj fosfora kvinoksido kaj helpis determini ĝian molekulan mason. La belga kemiisto Frédéric Swarts (1866-1940) studis la konvertadon de kloridoj en fluoridojn, Oskar Glemser (1911-2005) plenumis sennombrajn esplorojn pri fluoroderivaĵoj kaj malkovris la Freon-12. En 1886, Henri Moissan (1852-1907) reakciigis 2 partojn de maldike dividitan krioliton kun tri partoj de fosfora kvinoksido. Joseph Louis Gay-Lussac (1778-1850) interesiĝis pri la origino de la fluoro en homaj ostoj kaj priskribis plurajn fluoridojn. Louis-Jacques Thénard (1777-1857) studis la agadon de la kloro sur fosforo, ktp.
Krom tio, per fosforila trifluorido oni povas sintezi sennombrajn kemiaĵojn tiaj kiaj fluorosulfata acido (reakcio 12), dumetilamino-fosforil-fluorido (reakcio 1), fosfata acido (reakcioj 2, 3, 5, 6, 7 8), trifenil-fosfito (reakcio 4), trifluoro-pirimidino (reakcio 5), trifluoro-benzeno (reakcio 6), benzila fluorido (reakcio 7), vinil-benzeno (reakcio 8).
Fosforila trifluorido reakcias kun akvo, alkoholoj kaj acidoj. Ĝi estas solvebla en eteroj kaj hidrokarbonidoj. Ĝi plenumas sennombrajn senhidratigajn reakciojn konvertante nitrilojn en amidojn (reakcio 3) kaj barbiturata acido en trifluoro-pirimidinon (reakcio 5).
Sintezoj
[redakti | redakti fonton]Sintezo 1
[redakti | redakti fonton]- Preparado per traktado de arĝenta (II) sulfito kaj fosfora kvinfluorido:
Sintezo 2
[redakti | redakti fonton]- Preparado per interagado de kobalta (III) fluorido kaj fosforila klorido:
Sintezo 3
[redakti | redakti fonton]- Preparado per reakcio de kalia perklorato kaj fosfora trifluorido:
Sintezo 4
[redakti | redakti fonton]- Preparado per agado de natria sulfato sur fosfora trifluorido:
Sintezo 5
[redakti | redakti fonton]- Sintezo per traktado de fosforila klorido kun fluorida acido en ĉeesto de antimona kvinklorido kiel katalizilo:[3]
Sintezo 6
[redakti | redakti fonton]- Sintezo per reakcio inter fosfora kvinfluorido kaj akvo:
Sintezo 7
[redakti | redakti fonton]- Sintezo per interagado de fosforila klorido kaj zinka fluorido:
Sintezo 8
[redakti | redakti fonton]- Preparado per traktado de fosfora trifluorido sur oksigeno:
Sintezo 9
[redakti | redakti fonton]- Sintezo per agado de arsena trifluorido kaj fosforila klorido:
Sintezo 10
[redakti | redakti fonton]- Litia baterio enhavas la substancon litia heksafluorofosfato, kiu per hidrolizo produktas fosforilan fluoridon:[4]
Sintezo 11
[redakti | redakti fonton]- Preparado per traktado de fosfora kvinfluorido kaj fosfora kvinoksido:
Sintezo 12
[redakti | redakti fonton]- Reakcio de Swarts: En 1892, la belga kemiisto Frédéric Swarts (1866-1940), malkovrinto de la klorofluorokarbono Freon-12 elmontris la utilecon pri konvertado de kloridaj komponaĵoj en fluoridajn komponaĵojn.[5] Ekzemple: Fosforila klorido reakcias kun kalcia fluorido por formi fosforilan fluoridon kaj kalcian kloridon:
Reakcioj
[redakti | redakti fonton]Reakcio 1
[redakti | redakti fonton]- Fosforila fluorido reakcias kun dumetilamino por formi dumetilamino-fosforil-fluoridon kaj fluoridan acidon:[6]
Reakcio 2
[redakti | redakti fonton]- Preparado de fosfata acido per hidrolizo de fosforila fluorido:
Reakcio 3
[redakti | redakti fonton]- Verdire, fosforila trifluorido estas potenca senhidratiga agento. Ekzemple: Ĝi senhidratigas benzonitrilon por formi benzamidon. La akvo ekstraktita el la benzonitrilo reakcias kun POCl3 formante fluoridan acidon kaj fosfatan acidon:[7]
Reakcio 4
[redakti | redakti fonton]- Preparado de trifenil-fosfito per interagado de fosforila fluorido kaj fenil-natrio:
|
|
Reakcio 5
[redakti | redakti fonton]- Sintezo de la substanco 2,4,6-trifluoro-pirimidino per interagado de fosforila fluorido kun barbiturata acido:[7]
Reakcio 6
[redakti | redakti fonton]- Sintezo de 1,2,3-trifluoro-benzeno (CAS-numero 1489-53-8) ekde interagado de fosforila fluorido kun pirogajlolo:
Reakcio 7
[redakti | redakti fonton]- Preparado de benzila fluorido per interagado de fosforila trifluorido kaj benzila alkoholo:
Reakcio 8
[redakti | redakti fonton]- Sintezo de stireno (aŭ vinil-benzeno) per agado de fosforila trifluorido sur fenetila alkoholo:
Reakcio 9
[redakti | redakti fonton]- Preparado de trifluorosulfonata acido per reakcio inter fosforila fluorido kaj sulfura duoksido en akva medio:[8]
Vidu ankaŭ
[redakti | redakti fonton]- Fosfora kvinoksido
- Fosfora triklorido
- Fosfora tribromido
- Fosfora trifluorido
- Tiofosforila bromido
- Tiofosforila fluorido
- Tiofosforila jodido
- Tiofosforila klorido
- Fosforila bromido
- Fosforila klorido
- Fosforila jodido
Literaturo
[redakti | redakti fonton]Referencoj
[redakti | redakti fonton]- ↑ CRC Handbook of Chemistry and Physics
- ↑ Chemical Book
- ↑ Methodicum Chimicum
- ↑ Nature
- ↑ Report on a survey of the chemical literature dealing with fluorine-containing organic compounds
- ↑ ResearchGate
- ↑ 7,0 7,1 McGill School of Computer Science. Arkivita el la originalo je 2018-12-05. Alirita 2018-12-05 .
- ↑ Proceedings of the Royal Society of London







![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a133815724e6bf6cfb39eb43f1e6c1d96ea8d17)



![{\displaystyle {\mathsf {{\xrightarrow[{Magnezio}]{300^{o}C}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bdcef16069073bad377ac3c708b504c3f200d852)

![{\displaystyle {\mathsf {{\xrightarrow[{}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/af21b07e9e503bdbbee6814c136975f68f374663)









![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{140^{o}C}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e022138c1e055300c3eb368e38a936d73b30234e)


