Fluorosulfata acido
| Fluorosulfonata acido | |||||
| |||||
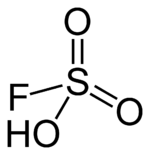
| Kemia strukturo de la Fluorosulfonata acido | |||||
| |||||
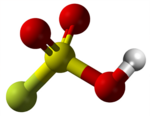
| 3D Kemia strukturo de la Fluorosulfata acido | |||||
| Alternativa(j) nomo(j) | |||||
| |||||
| Kemia formulo | |||||
| CAS-numero-kodo | 7789-21-1 | ||||
| ChemSpider kodo | 23005 | ||||
| PubChem-kodo | 24603 | ||||
| Fizikaj proprecoj | |||||
| Aspekto | Senkolora likvaĵo | ||||
| Smiles |
| ||||
| Denseco |
| ||||
| Fandopunkto | −87.5 °C; −125.4 ℉; 185.7 K | ||||
| Bolpunkto | 165.4 °C; 329.6 ℉; 438.5 K | ||||
| Acideco (pKa) | -10 | ||||
| Merck Index | 14,2165 | ||||
| Sekurecaj Indikoj | |||||
| Risko | R5 R8 R20 R35 | ||||
| Sekureco | (S1/2) S26 S45 | ||||
| Pridanĝeraj indikoj | |||||
| Danĝero
| |||||
| GHS etikedigo de kemiaĵoj | |||||
| GHS Damaĝo-piktogramo |
| ||||
| GHS Signalvorto | Damaĝa substanco | ||||
| GHS Deklaroj pri damaĝoj | H332, H314 | ||||
| GHS Deklaroj pri antaŭgardoj | P280, P305+351+338, P310 | ||||
(25 °C kaj 100 kPa) | |||||
Fluorosulfata acido, fluorosulfonata acido aŭ FSO2OH estas fluora okso-acido, unu el la plej fortaj acidoj komerce disponeblaj, kvaredra molekulo, senkolora likvaĵo, kvankam ĝiaj komercaj specimenoj ofte estas flavaj.
Proprecoj
[redakti | redakti fonton]Fluorosulfata acido estas solvebla en polaraj organikaj solvaĵoj (tiel kiel nitrobenzeno, acetata acido kaj etilacetato), sed malmulte solvebla en nepolaraj solvaĵoj tiel kiel la alkanoj. Rilate al ĝia forta acideco, ĝi dissolvas preskaŭ ĉiujn organikajn komponaĵojn, eĉ tiujn kiuj estas malfortaj protonacekceptantoj. Fluorosulfonata acido hidroliziĝas al fluorida acido kaj sulfata acido. La kunrilata triflata acido konservas la altan acidecon de la fluorosulfonata acido, tamen, ĝi estas pli hidrolize stabila. La memjonizigo de fluorosulfata acido ankaŭ eblas, laŭ la ekvacio:
Super-acidoj
[redakti | redakti fonton]FSO2OH estas unu el la plej fortaj simplaj acidoj konataj kiel acidoj de Brønsted, kvankam la acidoj surbaze de karboranoj estas pli fortaj. La kombinado inter FSO2OH kaj la acido de Lewis antimona kvinfluorido[1] produktas la magian acidon[2], kiu estas la plej forta protonigagento. Ĉi-acidoj apartenas al la kategorio de la superacidoj, kaj estas 100% pli fortaj ol sulfata acido.
Aplikoj
[redakti | redakti fonton]Fluorosulfata acido estas alte toksa kaj koroda substanco. Ĝi uzatas por gravurado de vitraĵoj. Ĝi izomerigas alkanojn kaj alkiligas hidrokarbonidojn en alkenojn, kvankam oni ne povas diri ke tiuj aplikoj estas komerce gravaj. En laboratorio, fluorosulfata acido uzatas kiel fluorigagento. Ĝi reakcias pli eksplode kun akvo ol sulfata acido.
Sintezo
[redakti | redakti fonton]- Fluorosulfata acido prepareblas pere de reakcio inter fluorida acido kaj sulfura trioksido:
- Ankaŭ per interagado de fluorida acido kaj klorosulfata acido:
- Traktado de kalia hidrogena fluorido aŭ kalia bifluorido kaj sulfura trioksido:
Reakcioj
[redakti | redakti fonton]- Fluorosulfonata acido hidroliziĝas al fluorida acido kaj sulfata acido.
- Neŭtraliga reakcio kun natria bikarbonato:
Literaturo
[redakti | redakti fonton]- Sigma Aldrich
- ACS Publications
- Cameo Chemicals
- Science Direct
- Chemical Book
- Acta Crystallographica
- Advances in Inorganic Chemistry and Radiochemistry, Volume 24
- Inorganic Chemistry, Egon Wiberg, Nils Wiberg
- Superacid Chemistry[rompita ligilo], George A. Olah, G. K. Surya Prakash, Jean Sommer, Arpad Molnar
| ||||||











