Imuna sistemo
La imuna sistemo[1] de plurĉela vivulo zorgas pri la defendo de ĉi tiu vivulo kontraŭ atakoj de virusoj, bakterioj, parazitoj, kanceriĝintaj ĉeloj, kaj iuj venenoj. La imunsistemoj multe varias inter la vivuloj. Ĉe la mamuloj (kaj do ĉe la homo) ĝi organiziĝas en du partoj, ne tute sendependaj.
Unuarangaj kaj duarangaj organoj
[redakti | redakti fonton]
La imuna sistemo konsistas el serio de organoj, histoj kaj ĉeloj amplekse disaj tra la tuta korpo. Funkcie, la organoj estas klasigeblaj en unuarangaj kaj duarangaj. La unuarangaj estas la osta medolo kaj la timuso, kiuj havigas la mikromedion por la matureco de la linfocitoj de la akirita imuneco. La duarangaj organoj estas la limfaj ganglioj, la lieno, la limfoida histo asocia al mukozoj (kaj parte ankaŭ la propra osta medolo) kie la imunaj ĉeloj migras kun la mikroorganismo aŭ antigeno en sian internon, havigante la taŭgan medion por ke la limfocitoj interagadu kun tiu, en la procezo nomita estado de antigeno.[2]
Imunaj defendolinioj
[redakti | redakti fonton]La imuna sistemo protektas la organismojn de la infektoj kun variaj defendolinioj de kreskanta specifeco. La unua defendolinio estas formata de la fizikaj, kemiaj kaj biologiaj barieroj kiuj estas la haŭto kaj ĉiuj mukozaj surfacoj de la organismo (digesta sistemo, spirsistemo, generurina sistemo, same kiel la okula konjunktivo), kiuj evitas, ke patogenoj kiel bakterioj kaj virusoj eniru en la organismo. Se patogeno penetras tiujn barierojn, la denaska imunsistemo havigas tujan reagon, sed ne specifan. La denaskaj elementoj de reago ekzistas en ĉiuj plantoj kaj animaloj.[3] Tamen, se la patogenaj agentoj evitas la denaskan reagon, la vertebruloj posedas trian nivelon de defendo, kiu estas la akirita imunreagon. Tiel la imunsistemo adaptas sian reagon dum la infekto por plibonigi la rekonon de la patogena agento. La informo pri tiu pliboniga reago estas konservata eĉ post la patogena agento estas eliminita, sub la formo de imuna memoro, kaj ebligas, ke la adapta imunsistemo okazigas atakojn pli rapidajn kaj pli fortajn se en la estonteco la imunsistemo detektas tiun tipon de patogeno.[4]
Denaskaj defendoj
[redakti | redakti fonton]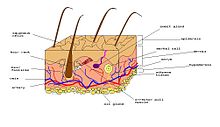
Ĉi tiuj estas la unuaj kaj plej fundamentaj defendoj kiujn homoj havas. Tiuj nomiĝas "denaskaj" ĉar preskaŭ ĉiuj homoj havas tiujn denaske.[5]
La unua denaska defendo estas la surfacaj baroj kiuj estas konsistigitaj de haŭto kaj mukozoj. Ambaŭ tre bone povas reteni eksterajn invadantojn. La haŭto (kondiĉe ke, ĝi ne rompiĝas) estas kvazaŭ muro kontraŭ la plejmulto de la mikroorganismoj. La mukozaj membranoj protektas la malfermojn en la korpo ekzemple la spiraj, urinaj aŭ digestaj vojoj, kaj la eksteraj seksorganoj. La mukozaj membranoj en la haŭto ankaŭ eligas acidajn sekreciojn kiuj haltas kreskon de bakterioj. Tiuj en la buŝo enhavas lisozimon kiu estas baktericida enzimo. Fine, la mukozo estas ia gluo kiu kaptas mikroorganismojn.[5]
La dua denaska defendo estas la internaj defendoj kiuj estas konsistigitaj de fagocitoj.[5]
La "hormona" imuna sistemo
[redakti | redakti fonton]Ĝi agas kontraŭ la bakterioj kaj virusoj en la korpaj likvaĵoj, kiel ekzemple la sango. Ĝiaj ĉefaj agantoj estas la imunoglobulinoj, produktitaj de la B-limfoĉeloj, kiuj devenas el la ostomedulo.
Adapta imunsistemo
[redakti | redakti fonton]
La adapta imunsistemo evoluis en fruaj vertebruloj kaj permesas pli fortan imunreagon same kiel imunologian memoron, en kiu ĉiu patogeno estas "memorigita" per signatura antigeno.[6] La adapta imunreago estas antigen-specifa kaj postulas la rekonon de specifaj "ne-memaj" antigenoj dum procezo nomita antigenprezento. Antigenspecifeco permesas la generadon de respondoj kiuj estas adaptitaj al specifaj patogenoj aŭ patogen-infektitaj ĉeloj. La kapablo munti tiujn adaptitajn respondojn estas konservita en la korpo per "memorĉeloj". Se patogeno infektus la korpon pli ol unufoje, tiuj specifaj memorĉeloj estas uzataj por rapide forigi ĝin.[7]
Rekono de antigeno
[redakti | redakti fonton]La ĉeloj de la adapta imunsistemo estas specialaj specoj de leŭkocitoj, nomitaj limfocitoj. B-ĉeloj kaj T-ĉeloj estas la plej gravaj specoj de limfocitoj kaj estas derivitaj de hematopoietaj stamĉeloj en la osta medolo.[8] B-ĉeloj estas implikitaj en la humura imunreago, dum T-ĉeloj estas engaĝitaj en ĉel-perita imunreago. Mortigaj T-ĉeloj nur rekonas antigenojn kunligitajn al Class I MHC-molekuloj, dum helpaj T-ĉeloj kaj reguligaj T-ĉeloj nur rekonas antigenojn kunligitajn al Class II MHC-molekuloj. Tiuj du mekanismoj de antigenprezento reflektas la malsamajn rolojn de la du specoj de T-ĉelo. Tria, minora subtipo estas la γδ T-ĉeloj kiuj rekonas sendifektajn antigenojn kiuj ne estas ligitaj al MHC-receptoroj.[9] La duoble-pozitivaj T-ĉeloj estas eksponitaj al vasta gamo de mem-antigenoj en la timuso, en kiuj jodo estas necesa por sia timusdisvolvo kaj agado..[10] Kontraste, la B-ĉela antigen-specifa receptoro estas antikorpa molekulo sur la B-ĉelsurfaco kaj rekonas indiĝenan (neprilaboritan) antigenon sen iu bezono de antigenpretigo. Tiaj antigenoj povas esti grandaj molekuloj trovitaj sur la surfacoj de patogenoj, sed ankaŭ povas esti malgrandaj haptenoj (kiel ekzemple penicilino) ligitaj al portanta molekulo.[11] Ĉiu genlinio de B-ĉelo esprimas malsaman antikorpon, do la kompleta aro de B-ĉelaj antigen-receptoroj reprezentas ĉiujn antikorpojn kiujn la korpo povas produkti.[8] Kiam B- aŭ T-ĉeloj renkontas siajn rilatajn antigenojn ili multiĝas kaj estas produktitaj multaj "klonoj" de la ĉeloj, kiuj celas la saman antigenon. Tio estas nomita klona selektado.[12]
Antigenprezentado ĉe T-limfocitoj
[redakti | redakti fonton]Kaj B-ĉeloj kaj T-ĉeloj portas receptormolekulojn kiuj rekonas specifajn celojn. T-ĉeloj rekonas "ne-mem" celon, kiel ekzemple patogeno, nur post kiam antigenoj (malgrandaj fragmentoj de la patogeno) estis prilaboritaj kaj prezentitaj en kombinaĵo kun "mem" receptoro nomita molekulo de grava histokongrua komplekso (MHC).[13]
Ĉel-perita imuneco
[redakti | redakti fonton]Estas du gravaj subtipoj de T-ĉeloj: la mortiga T-ĉelo kaj la helpanta T-ĉelo. Krome ekzistas reguligaj T-ĉeloj kiuj havas rolon en modulado de imunreago.[14]
Mortigaj T-ĉeloj
[redakti | redakti fonton]Mortigaj T-ĉeloj estas subgrupo de T-ĉeloj kiuj mortigas ĉelojn kiuj estas infektitaj kun virusoj (kaj aliaj patogenoj), aŭ estas alie difektitaj aŭ disfunkciaj.[15] Kiel ĉe B-ĉeloj, ĉiu speco de T-ĉelo rekonas malsaman antigenon. Mortigaj T-ĉeloj estas aktivigitaj kiam ilia T-ĉelreceptoro ligas al tiu specifa antigeno en komplekso kun la MHC Klaso I-receptoro de alia ĉelo. Rekono de tiu MHC:antigenkomplekso estas helpita per kun-receptoro sur la T-ĉelo, nomita CD8. La T-ĉelo tiam vojaĝas ĉie en la korpo serĉante ĉelojn kie la MHC I-receptoroj portas tiun antigenon. Kiam aktivigita T-ĉelo kontaktas tiajn ĉelojn, ĝi liberigas citotoksinojn, kiel ekzemple perforino, kiuj formas porojn en la plasmomembrano de la celĉelo, permesante al jonoj, akvo kaj toksinoj eniri. La eniro de alia toksino nomita granulisino (proteazo) instigas la celĉelon trairi apoptozon.[16] T-ĉelmortigo de gastigaj ĉeloj estas precipe grava por malhelpi la reproduktadon de virusoj. T-ĉel-aktivigo estas malloze kontrolita kaj ĝenerale postulas tre fortan MHC/antigenan aktivigsignalon, aŭ kromajn aktivigajn signalojn disponigitajn per "helpantaj" T-ĉeloj (vidu malsupre).[16]
Helpilaj T-ĉeloj
[redakti | redakti fonton]
Helpilaj T-ĉeloj reguligas kaj la denaskajn kaj la adaptajn imunreagojn kaj helpas determini kiujn imunreagojn la korpo faras al speciala patogeno.[17][18] Tiuj ĉeloj havas neniun citotoksan agadon kaj ne mortigas infektitajn ĉelojn aŭ purigas patogenojn rekte. Ili anstataŭe kontrolas la imunreagon direktante aliajn ĉelojn por plenumi tiujn taskojn.[19]
Helpaj T-ĉeloj esprimas T-ĉelreceptorojn kiuj rekonas antigenon ligitan al Klaso II MHC-molekuloj. La MHC:antigenkomplekso ankaŭ estas rekonita per la CD4-kun-receptoro de la helpĉelo, kiu rekrutas molekulojn ene de la T-ĉelo (kiel ekzemple Tirosin-proteina kinazo Lck) kiuj respondecas pri la aktivigo de la T-ĉelo. Helpantaj T-ĉeloj havas pli malfortan asocion kun la MHC:antigenkomplekso ol observite por mortigaj T-ĉeloj, signifante ke multaj receptoroj (ĉirkaŭ 200-300) sur la helpoĉelo devas esti ligitaj per MHC:antigeno por aktivigi la helpoĉelon, dum mortigaj T-ĉeloj povas esti aktivigitaj per engaĝiĝo de ununura MHC:antigena molekulo. Aktivigo de la helpa T-ĉelo ankaŭ postulas pli longan daŭron de engaĝiĝo kun antigen-prezentanta ĉelo.[20] La aktivigo de ripoza helpanta T-ĉelo igas ĝin liberigi citokinojn kiuj influas la agadon de multaj ĉeltipoj. Citokinsignaloj produktitaj de helpantaj T-ĉeloj plibonigas la mikrobicidan funkcion de makrofagoj kaj la agadon de mortigaj T-ĉeloj.[21] Krome, aktivigo de la helpanta T-ĉelo kaŭzas suprenreguligon de molekuloj esprimitaj sur la surfaco de la T-ĉelo, kiel ekzemple CD40-peranto (nomita ankaŭ CD154), kiuj havigas ekstrajn stimulajn signalojn tipe necesajn por aktivigi antikorp-produktantajn B-ĉelojn.[22]
Gamma-deltaj T ĉeloj
[redakti | redakti fonton]Gamma-deltaj T-ĉeloj (γδ T-ĉeloj) posedas alternativan T-ĉelreceptoron (TCR) kontraste al CD4+ kaj CD8+ (αβ) T-ĉeloj kaj dividas la karakterizaĵojn de helpantaj T-ĉeloj, citotoksaj T-ĉeloj kaj NK-ĉeloj. La kondiĉoj kiuj produktas respondojn de γδ T-ĉeloj ne estas plene komprenitaj. Kiel aliaj "netradiciaj" T-ĉeloj subaroj portantaj senvariajn TCR-ojn, kiel ekzemple CD1d-restriktitaj naturaj murdĉeloj T, γδ T-ĉeloj interkrurigas la limon inter denaska kaj adapta imunecoj.[23] Unuflanke, γδ T-ĉeloj estas komponento de adapta imuneco, ĉar ili rearanĝas TCR-genojn por produkti receptordiversecon kaj ankaŭ povas evoluigi memorfenotipon. Aliflanke, la diversaj subaroj ankaŭ estas parto de la denaska imunsistemo, ĉar limigitaj TCR aŭ NK-receptoroj povas esti utiligitaj kiel padronrekonaj receptoroj. Ekzemple, grandaj nombroj da homaj Vγ9/Vδ2 T-ĉeloj respondas ene de horoj al oftaj molekuloj produktitaj de mikroboj, kaj tre limigitaj Vδ1+ T-ĉeloj en epitelio respondas al streĉitaj epiteliĉeloj.[9]
La "ĉela" imuna sistemo
[redakti | redakti fonton]Ĝi zorgas pri la ĉeloj infektitaj de virusoj aŭ bakterioj kaj pri la kanceraj ĉeloj. Ĉefaj agantoj estas la T-limfoĉeloj, kiuj maturiĝas en la timuso post naskiĝo en la ostomedulo. Ekzistas du grandaj tipoj de T-limfoĉeloj:
- la T-ĉelvenenaj limfoĉeloj (TĈ) rekonas la infektitajn ĉelojn per rekoniloj, kiuj testas la eksteran membranon de aliaj ĉeloj. La rekonitaj ĉeloj estas detruitaj kune kun la viruso, kiun ili entenas.
- la T-helpantaj limfoĉeloj interagas kun la makrofagoj (kiuj englutas la danĝerajn substancojn) kaj ankaŭ produktas citokinojn, kiuj stimulas la multobliĝon de la limfoĉeloj T kaj B.
Al la T-limfoĉeloj aldoniĝas la t. n. "NM-ĉeloj" (por Natura Murdisto aŭ Natura Mortiganto, do Natural Killer – NK en la angla). Ĉi tiuj ĉeloj rolas interalie komence de la gravedeco, kiam la feto devas protekti sin por supervivi en la patrina utero.
Disordoj de homa imuneco
[redakti | redakti fonton]Fiaskoj de gastiga defendo okazas kaj estas klasitaj en tri larĝajn kategoriojn: imunomankoj,[24] memimuneco,[25] kaj hipersentemoj.[26]
Imunomankoj
[redakti | redakti fonton]Imunomankoj okazas kiam unu aŭ pliaj komponantoj de la imunsistemo estas neaktivaj. La kapablo de la imunsistemo por respondi al patogenoj estas malpliigita en kaj junuloj kaj maljunuloj, kaj imunreagoj komencas malkreski je proksimume 50 jaroj de aĝo pro imunosenesko.[27][28] En evoluintaj landoj, trodikiĝo, alkoholismo kaj droguzado estas oftaj kaŭzoj de malbona imunfunkcio, dum malsufiĉa nutrado estas la plej ofta kaŭzo de imunomanko en evolulandoj.[28] Dietoj al kiuj mankas sufiĉa proteino estas rilataj al difektita ĉel-perita imuneco, komplementagado, fagocitfunkcio, IgA-antikorpkoncentriĝoj, kaj citokinproduktado. Aldone, la perdo de la timuso en frua aĝo pro genetika mutacio aŭ kirurgia forigo rezultigas severan imunomankon kaj altan malsaniĝemecon al infekto.[29] Imunomankoj ankaŭ povas esti hereditaj aŭ 'akiritaj'.[30] Severa kombinita imunomanko estas malofta genetika malsano karakterizita per la ĝenita evoluo de funkciaj T-ĉeloj kaj B-ĉeloj kaŭzitaj de multaj genetikaj mutacioj.[31] Kronika granulomatoza malsano, kie fagocitoj havas reduktitan kapablon detrui patogenojn, estas ekzemplo de heredita, aŭ denaska, imunomanko. Aidoso kaj iuj specoj de kancero kaŭzas akiritan imunomankon.[32][33]
Memimuneco
[redakti | redakti fonton]
Troaktivaj imunreagoj formas la alian finon de imuna misfunkcio, precipe la aŭtoimunaj malsanoj. Ĉi tie, la imunsistemo ne sukcesas ĝuste distingi inter mem-proteino kaj ne-memo, kaj atakas parton de la korpo. En normalaj cirkonstancoj, multaj T-ĉeloj kaj antikorpoj reagas kun "mem" peptidoj.[34] Unu el la funkcioj de specialigitaj ĉeloj (lokigitaj en la timuso kaj en la osta medolo) estas prezenti junajn limfocitojn kun memantigenoj produktitaj ĉie en la korpo kaj forigi tiujn ĉelojn kiuj rekonas mem-antigenojn, malhelpante memimunecon.[35] Oftaj memimunaj malsanoj estas la tiroidito de Haŝimoto,[36] la reŭmatoida artrito,[37] diabeto mellitus tipo 1,[38] kaj ĉiea lupuson eritematozo.[39]
Hipersentemo
[redakti | redakti fonton]Hipersentemo estas imuna respondo kiu damaĝas la proprajn histojn de la korpo. Ĝi estas dividita en kvar klasojn (Tipo I - IV) surbaze de la mekanismoj implikitaj kaj la tempokurso de la hipersentema reago. Tipo I hipersenstemo estas tuja aŭ anafilaksia reago, ofte asociita kun alergio. Simptomoj povas varii de milda malkomforto ĝis morto. Tipo I hipersentemo estas perita per imunoglobulino IgE, kiu ekigas degranuladon de mastocitoj kaj bazofiloj kiam krucligite per antigeno.[40]
Tipo II-hipersentemo okazas kiam antikorpoj ligiĝas al antigenoj sur la propraj ĉeloj de la individuo, markante ilin por detruo. Tio ankaŭ estas nomita antikorp-dependa (aŭ citotoksa) hipersentemo, kaj estas perita per imunoglobulino IgG kaj IgM antikorpoj.[40] Imunkompleksoj (agregadoj de antigenoj, komplementproteinoj, kaj IgG kaj IgM antikorpoj) deponitaj en diversaj histoj ekigas Tipo III-hipersentemajn reagojn.[40] Tipo IV-hipersentemo (konata ankaŭ kiel ĉel-perita aŭ hipersentemo de prokrastita tipo) kutime daŭras inter du kaj tri tagojn por disvolvi. Tipo IV-reagoj estas implikitaj en multaj memimunaj kaj infektaj malsanoj, sed ankaŭ povas impliki kontaktodermiton. Tiuj reagoj estas peritaj de T-ĉeloj, monocitoj kaj makrofagoj.[40]
Idiopatia inflamo
[redakti | redakti fonton]Inflamo estas unu el la unuaj reagoj de la imunsistemo al infekto,[41] sed ĝi povas aperi sen konata kaŭzo.
Inflamo estas produktita de eikosanoidoj kaj citokinoj, kiuj estas priduktitaj de vunditaj aŭ infektitaj ĉeloj. Eikosanoidoj inkludas prostaglandinojn kiuj produktas febron kaj la dilaton de sangotuboj asociita kun inflamo, kaj leŭkotrienojn, kiuj altiras iomajn blankajn globulojn (leŭkocitoj).[42][43] Oftaj citokinoj inkluzivas interleukinojn, kiuj respondecas pri komunikado inter blankaj globuloj; kemokinojn, kiuj antaŭenigas kemitaksison; kaj interferonojn, kiuj havas kontraŭvirusajn efikojn, kiel ĉesigi proteinsintezon en la gastiga ĉelo.[44] Oni povas produkti ankaŭ kreskofaktorojn kaj citotoksajn faktorojn. Tiuj citokinoj kaj aliaj kemiaĵoj rekrutas imunajn ĉelojn en la loko de infekto kaj antaŭenigas resanigon de ajna difektita histo post la forigo de patogenoj.[45]
Historio de la imunologio
[redakti | redakti fonton]
La imunologio estas scienco kiu ekzamenas la strukturon kaj funkciadon de la imunsistemo. Ĝi originiĝis en la medicino kaj en la unuaj studoj pri la kaŭzoj de la imuneco al la malsanoj. La plej antikva referenco al imuneco okazis dum la plago de Ateno en la jaro 430 a.n.e., kiam Tucidido notis,ke kelkaj personoj kiuj jam estis rekuperiĝintaj de antaŭa ekskesplodo de la malsano povis zorgi la malsanulojn sen suferi la malsanon por la dua fojo.[46] Tiu observo pri akirita imuneco estis poste uzata de Louis Pasteur en la disvolvigo de la vakcino kaj en sia mikroba teorio de la malsano.[47] La teorio de Pasteur opoziciis al la tiutempaj teorioj pri la malsanoj, kiaj la "miasma teorio". Oni konfirmis, ke la mikroorganismoj estas la kaŭzo de la infektaj malsanoj nur en 1891, kiam Robert Koch disvastigis siajn postulatojn, pro kio li ricevis la Nobel-premion en 1905.[48] En 1901, pro la malkovro de la viruso de la flava febro fare de Walter Reed, oni konfirmis, ke la virusoj estas homaj patogenoj.[49]
Okazis granda progreso en la imunologio ĉirkaŭ la fino de la 19-a jarcento, pere de la rapida disvolvigo de la studoj pri humora imuneco kaj pri ĉela imuneco.[50] De partikulara gravo rezultis la laboro de Paul Ehrlich, kiu proponis la Seitenkettentheorie (teorio de la flanka ĉeno) por klarigi la specifecon de la reakcio antigeno-antikorpo; liaj kontribuoj al la kompreno de la humora (hormona) imunologio estis agnoskitaj per la Nobel-premio en 1908, ricevita kune kun Ilja Meĉnikov, nome la fondinto de la ĉela imunologio.[51]
Peter Gorer malkovrris en 1936 la antigenon H-2 de la muso, kaj tiel la unuan grandan komplekson de histoakordigebleco (MHC laŭ internacia anglalingva mallongigo de major histocompatibility complex). Dume kaj tial, Peter Medawar kaj Thomas Gibson povis klarigi gravajn funkciojn de la imunĉeloj. En 1948, Astrid Fagraeus malkovris, ke la antikorpoj estis produktitaj de la B-ĉeloj de la plasmo. Unu jaron poste, Frank Macfarlane Burnet kaj Frank Fenner publikigis sian hipotezon pri la imuntolero, kio estos konfirmita kelkajn jarojn poste fare de Jacques Miller per la malkovro de la eliminado de T-ĉeloj memreakciaj en la timuso. En 1957, Frank Macfarlane Burnet priskribis la teorion de la klonselekto kiel centra principo de la adapta imuneco.[52]
Fine de la 1960-aj jaroj kaj komence de la 1970-aj jaroj, John David kaj Barry Bloom malkovris la Faktoron Inhibician de Migrado de la Makrofagoj (MIF) kaj nova klaso de substancoj sekreciataj de la limfocitoj. Dudley Dumonde stampis la terminon "limfocino" por tiuj substancoj. Stanley Cohen, kiu en 1986 ricevis la Nobel-premion pri fiziologio aŭ medicino pro sia malkovro de la kreskofaktoroj NGF kaj EGF,[53][54] ekstudis komence de la 1970-aj jaroj la funkciojn de la faktoroj nomitaj "limfocinoj" kun Takeshi Yoshida. Ili malkovris, ke tiuj substancoj apartenas al grupo de substancoj mensaĝistaj kiuj estas produktitaj de multaj diversaj tipoj de ĉeloj de la imunsistemo. En 1974 Stanley Cohen proponis la terminon "citokino", kiu plifirmiĝis per la malkovro de pliaj substancoj tiutipaj. Ekde tiam oni malkovris pli ol cent novaj citokinoj, kies strukturo kaj funkcioj estis esploritaj detale.
Bildaro
[redakti | redakti fonton]-
Buŝa vakcino kontraŭ poliomjelito donata al infano
Referencoj
[redakti | redakti fonton]- ↑ imuna sistemo en PIV ĉe vortaro.net
- ↑ [1]
- ↑ Litman G, Cannon J, Dishaw L (2005). «Reconstructing immune phylogeny: new perspectives.». Nat Rev Immunol 5 (11): 866-79. PMID 16261174.
- ↑ Mayer, Gene (2006). «Immunology - Chapter One: Innate (non-specific) Immunity». Microbiology and Immunology On-Line Textbook. USC School of Medicine. Arkivita el la originalo en la 16a de februaro 2007. Konsultita la 8an de Aŭgusto 2021.
- ↑ 5,0 5,1 5,2 Human Anatomy and Physiology (6th edition) Elaine N. Marieb unit 21
- ↑ (2006) “The evolution of adaptive immunity”, Annual Review of Immunology 24 (1), p. 497–518. doi:10.1146/annurev.immunol.24.021605.090542.
- ↑ Sompayrac 2019, p. 38.
- ↑ 8,0 8,1 Janeway 2005.
- ↑ 9,0 9,1 (2005) “gammadelta T cells link innate and adaptive immune responses”, Chemical Immunology and Allergy 86, p. 151–83. doi:10.1159/000086659.
- ↑ (Septembro 2009) “Iodine, thymus, and immunity”, Nutrition 25 (9), p. 977–79. doi:10.1016/j.nut.2009.06.002.
- ↑ Janeway, Travers & Walport 2001, sec. 12-10.
- ↑ Sompayrac 2019, pp. 5–6.
- ↑ Sompayrac 2019, pp. 51–53.
- ↑ Sompayrac 2019, pp. 7–8.
- ↑ (2000) “CD8+ T cell effector mechanisms in resistance to infection”, Annual Review of Immunology 18 (1), p. 275–308. doi:10.1146/annurev.immunol.18.1.275.
- ↑ 16,0 16,1 (2006) “T-cell receptor signaling events triggering granule exocytosis”, 'Critical Reviews in Immunology' 26 (3), p. 265–90. doi:10.1615/CritRevImmunol.v26.i3.40.
- ↑ (Oct 1996) “Functional diversity of helper T lymphocytes”, Nature 383 (6603), p. 787–93. doi:10.1038/383787a0. Bibkodo:1996Natur.383..787A. 4319699.
- ↑ (2006) “Helper T cell-regulated B cell immunity”, From Innate Immunity to Immunological Memory, Current Topics in Microbiology and Immunology 311, p. 59–83. doi:10.1007/3-540-32636-7_3. ISBN 978-3-540-32635-9.
- ↑ Sompayrac 2019, p. 8.
- ↑ (Nov 2002) “Human CD8+ T cells do not require the polarization of lipid rafts for activation and proliferation”, Proceedings of the National Academy of Sciences of the United States of America 99 (23), p. 15006–11. doi:10.1073/pnas.232058599. Bibkodo:2002PNAS...9915006K.
- ↑ Alberts et al. 2002, Chapter. "Helper T Cells and Lymphocyte Activation".
- ↑ (1998) “CD40 and CD154 in cell-mediated immunity”, Annual Review of Immunology 16 (1), p. 111–35. doi:10.1146/annurev.immunol.16.1.111.
- ↑ (Jan 2006) “Immunosurveillance and immunoregulation by gammadelta T cells”, The Journal of Investigative Dermatology 126 (1), p. 25–31. doi:10.1038/sj.jid.5700003.
- ↑ Sompayrac 2019, pp. 120–24.
- ↑ Sompayrac 2019, pp. 114–18.
- ↑ Sompayrac 2019, pp. 111–14.
- ↑ (Aprilo 2007) “Immunosenescence: emerging challenges for an ageing population”, Immunology 120 (4), p. 435–46. doi:10.1111/j.1365-2567.2007.02555.x.
- ↑ 28,0 28,1 (Aŭgusto 1997) “Nutrition and the immune system: an introduction”, The American Journal of Clinical Nutrition 66 (2), p. 460S–63S. doi:10.1093/ajcn/66.2.460S.
- ↑ (Julio 2002) “The discovery of thymus function and of thymus-derived lymphocytes”, Immunological Reviews 185 (1), p. 7–14. doi:10.1034/j.1600-065X.2002.18502.x. 12108587.
- ↑ Reece 2011, p. 967.
- ↑ (2011) “Educational paper: The expanding clinical and immunological spectrum of severe combined immunodeficiency”, Eur J Pediatr 170 (5), p. 561–571. doi:10.1007/s00431-011-1452-3.
- ↑ (2005) “Breakdown of pulmonary host defense in the immunocompromised host: cancer chemotherapy”, Proceedings of the American Thoracic Society 2 (5), p. 445–48. doi:10.1513/pats.200508-097JS.
- ↑ (Decembro 1996) “T helper cell activation and human retroviral pathogenesis”, Microbiological Reviews 60 (4), p. 722–42. doi:10.1128/MMBR.60.4.722-742.1996.
- ↑ (1993) “Self-nonself discrimination and tolerance in T and B lymphocytes”, Immunologic Research 12 (2), p. 115–30. doi:10.1007/BF02918299. 32476323.
- ↑ Sproul TW, Cheng PC, Dykstra ML, Pierce SK (2000). "A role for MHC class II antigen processing in B cell development". International Reviews of Immunology. 19 (2–3): 139–55. doi:10.3109/08830180009088502. PMID 10763706. S2CID 6550357.
- ↑ "Hashimoto's disease". Office on Women's Health, U.S. Department of Health and Human Services. 12a de Junio 2017. Arkivita el la originalo la 28an de Julio 2017. Alirita la 17an de Julio 2017.
- ↑ (Oktobro 2016) “Rheumatoid arthritis”, 'Lancet' 388 (10055), p. 2023–2038. doi:10.1016/S0140-6736(16)30173-8. 37973054.
- ↑ (Julio 2015) “Glucagon - the new 'insulin' in the pathophysiology of diabetes”, 'Current Opinion in Clinical Nutrition and Metabolic Care' 18 (4), p. 407–14. doi:10.1097/mco.0000000000000192. 19872862.
- ↑ Handout on Health: Systemic Lupus Erythematosus (Februaro 2015). Arkivita el la originalo je 17a de Junio 2016. Alirita 12a de Junio 2016 .
- ↑ 40,0 40,1 40,2 40,3 Immunology – Chapter Seventeen: Hypersensitivity States. Microbiology and Immunology On-line. University of South Carolina School of Medicine (2006). Alirita 29a de Majo 2016 .
- ↑ Kawai T, Akira S (Februaro 2006). "Innate immune recognition of viral infection". Nature Immunology. 7 (2): 131–37. doi:10.1038/ni1303. PMID 16424890. S2CID 9567407.
- ↑ Miller SB (Aŭgusto 2006). "Prostaglandins in health and disease: an overview". Seminars in Arthritis and Rheumatism. 36 (1): 37–49. doi:10.1016/j.semarthrit.2006.03.005. PMID 16887467.
- ↑ Ogawa Y, Calhoun WJ (Oktobro 2006). "The role of leukotrienes in airway inflammation". The Journal of Allergy and Clinical Immunology. 118 (4): 789–98, quiz 799–800. doi:10.1016/j.jaci.2006.08.009. PMID 17030228.
- ↑ Le Y, Zhou Y, Iribarren P, Wang J (Aprilo 2004). "Chemokines and chemokine receptors: their manifold roles in homeostasis and disease" (PDF). Cellular & Molecular Immunology. 1 (2): 95–104. PMID 16212895.
- ↑ Martin P, Leibovich SJ (Novembro 2005). "Inflammatory cells during wound repair: the good, the bad and the ugly". Trends in Cell Biology. 15 (11): 599–607. doi:10.1016/j.tcb.2005.09.002. PMID 16202600.
- ↑ Retief F, Cilliers L (1998). «The epidemic of Athens, 430-426 BC». S Afr Med J 88 (1): 50-3. PMID 9539938.
- ↑ Plotkin S (2005). «Vaccines: past, present and future». Nat Med 11 (4 Suppl): S5-11. PMID 15812490.
- ↑ El Premio Nobel de Medicina de 1905 Nobelprize.org Vizitita la 8an de Januaro 2007 (en angla).
- ↑ Maĵoro Walter Reed, armekuracisto de la Usona Armeo Walter Reed Army Medical Center. Vizitita la 8an de Januaro 2007.
- ↑ Metchnikoff, Elie; Tradukita de F.G. Binnie. (1905). Immunity in Infective Diseases (Google Books). Cambridge University Press. ISBN 68025143
- ↑ Nobel Premio pri Medicino de 1908 Nobelprize.org Vizitita la 8an de Januaro 2007.
- ↑ Forsdyke, D. R. (1995). "The Origins of the Clonal Selection Theory of Immunity" Arkivigite je 2012-07-30 per la retarkivo Wayback Machine FASEB. Journal 9:164-66
- ↑ Shampo, M A; Kyle R A (Junio 1999). «Stanley Cohen--Nobel laureate for growth factor». Mayo Clin. Proc. (Usono) 74 (6): 600. ISSN 0025-6196. PMID 10377936.
- ↑ Nobel-premio pri fiziologio aŭ medicino 1986 Nobelprize.org Konsultita la 28an de julio 2011.
Bibliografio
[redakti | redakti fonton]- Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walters P (2002). Molecular Biology of the Cell (kvara eldono). Novjorko kaj Londono: Garland Science. ISBN 978-0-8153-3218-3.
- Bertok L, Chow D (2005). Bertok L, Chow D (eld.). Natural Immunity. Vol. 5 (unua eld.). Elsevier Science. ISBN 978-0-44451-755-5.
- Iriti M (2019). Plant Innate Immunity 2.0. Basel: MDPI. doi:10.3390/books978-3-03897-581-6. ISBN 978-3-03897-580-9. OCLC 1105775088.
- Ciccone CD (2015). Pharmacology in Rehabilitation (Contemporary Perspectives in Rehabilitation) (kvina eld.). F.A. Davis Company. ISBN 978-0-80364-029-0.
- Janeway CA, Travers P, Walport M (2001). Immunobiology (kvina eld.). Garland Science.
- Janeway CA (2005). Immunobiology (sesa eld.). Garland Science. ISBN 0-443-07310-4.
- Krishnaswamy G, Ajitawi O, Chi DS (2006). "The human mast cell: an overview". Mast Cells. Methods in Molecular Biology. Vol. 315. pp. 13–34. doi:10.1385/1-59259-967-2:013. ISBN 1-59259-967-2. PMID 16110146.
- Murphy K, Weaver C (2016). Immunobiology (naŭa eld.). Garland Science. ISBN 978-0-8153-4505-3.
- Rajalingam R (2012). "Overview of the Killer Cell Immunoglobulin-Like Receptor System". Immunogenetics. Methods in Molecular Biology. Vol. 882. pp. 391–414. doi:10.1007/978-1-61779-842-9_23. ISBN 978-1-61779-841-2. PMID 22665247.
- Reece J (2011). Campbell biology. Frenchs Forest, N.S.W: Pearson Australia. ISBN 978-1-4425-3176-5. OCLC 712136178.
- Silverstein AM (1989). A History of Immunology. Academic Press. ISBN 978-0-08-092583-7.
- Sompayrac L (2019). How the immune system works. Hoboken, NJ: Wiley-Blackwell. ISBN 978-1-119-54212-4. OCLC 1083261548.
- Stvrtinová V, Jakubovský J, Hulín I (1995). Pathophysiology: Principles of Disease. Computing Centre, Slovak Academy of Sciences: Academic Electronic Press.
- Wira CR, Crane-Godreau M, Grant K (2004). Ogra PL, Mestecky J, Lamm ME, Strober W, McGhee JR, Bienenstock J (eld.). Mucosal Immunology. San Francisco: Elsevier. ISBN 0-12-491543-4.



