Izoftalata acido
| Izoftalata acido | ||

| ||
| Kemia strukturo de la Izoftalata acido | ||

| ||
| 3D Kemia strukturo de la Izoftalata acido | ||
| Kemia formulo | ||
| Alternativa(j) nomo(j) | ||
| 1,3-benzenodukarboksilata acido | ||
| CAS-numero-kodo | 121-91-5 | |
| ChemSpider kodo | 8182 | |
| PubChem-kodo | 8496 | |
| Fizikaj proprecoj | ||
| Aspekto | Blanka kristala solido | |
| Molmaso | 166,14 g mol−1 | |
| Denseco | 1,526 g/cm3 | |
| Fandopunkto | 348,5 °C (sublimiĝas) | |
| Solvebleco | Akvo:0,12 g/L | |
| Acideco (pKa) |
| |
| Merck Index |
| |
| Sekurecaj Indikoj | ||
| Risko | R36/37/38 | |
| Sekureco | S24 S25 S26 S36 | |
| Pridanĝeraj indikoj | ||
| Danĝero
| ||
| GHS etikedigo de kemiaĵoj | ||
| GHS Damaĝo-piktogramo |
| |
| GHS Signalvorto | Averto | |
| GHS Deklaroj pri damaĝoj | H315, H319, H335 | |
| GHS Deklaroj pri antaŭgardoj | P261, P264, P271, P280, P302+352, P304+340, P305+351+338, P312, P321, P332+313, P337+313, P362+364, P403+233, P405, P501 | |
(25 °C kaj 100 kPa) | ||
Izoftalata acido, hidrogena izoftalato aŭ C6H4(COOH)2 estas organika kombinaĵo, senkolora aŭ blanka solido kaj izomero de la ftalata acido kaj tereftalata acido. Izoftalata acido estas blankaj kristaloj kiuj sublimiĝas ĉe 345 °C kaj estas malmulte solvebla en akvo, alkoholo kaj acetata acido.
Ĝi estas preparebla per oksidado de meta-ksileno en ĉeesto de kromiata acido aŭ pere de fandiĝo de kalia meta-sulfobenzoato aŭ meta-bromobenzoato kaj kalia formiato.[1] Izoftalata acido havas bonegajn plenumkarakterizaĵojn inklude de bonega malmoleco, koroda kaj makula rezistadoj, hidrolize stabila, kaj alte uzata en industriaj farbokovraĵoj.
Sintezo
[redakti | redakti fonton]- Izoftalata acido produkteblas per oksidado de m-ksileno pere de kobalto-mangana katalizilo:
 + 3 O2
+ 3 O2  + 2 H2O
+ 2 H2O
- Bilionoj da kilogramoj de izoftalata acido produkteblas ĉiujare per oksidado de meta-ksileno en la ĉeesto de kromiata acido kiel oksidiganto aŭ pere de kobalto-mangana katalizilo. En la laboratorio, kromiata acido uzatas kiel oksidiganto. Ĝi same estigeblas per fandado de kalia meta-sulfobenzoato aŭ meta-bromobenzoato kaj kalia formiato. Tereftalata acido same formiĝas en ĉi-lasta kazo.
La baria salo, same kiel ĝia heksahidrato, estas tre solvebla, kaj tio uzatas por diferencigo inter ftalata kaj tereftalata acidoj. La uvitata acido aŭ 5-metila-izoftalata acido, prepareblas per oksidigo de la mezitileno aŭ kondensiĝo de la piroracemata acido kun baritakvo.
Reakcioj
[redakti | redakti fonton]Reakcio 1
[redakti | redakti fonton]- Preparado de 5-fosfono-izoftalata acido per interagado de fosfata acido kun izoftalata acido:
Reakcio 2
[redakti | redakti fonton]- Preparado de Sulfo-izoftalata acido per interagado de sulfata acido kun izoftalata acido:
Reakcio 3
[redakti | redakti fonton]- Preparado de 5-nitro-izoftalata acido per interagado de nitrata acido kun izoftalata acido:
Reakcio 4
[redakti | redakti fonton]- Preparado de 5-amino-izoftalata acido per interagado de kloramino kun izoftalata acido:
Uzoj
[redakti | redakti fonton]Aromataj dukarboksilataj acidoj, sub la formo de acilaj kloridoj (R-C=OCl), uzatas kiel antaŭaĵoj al komerce gravaj polimeroj, ekzemple de fajrorezista materialo konata kiel Nomex[2]. Kiam miksitaj kun tereftalata acido, tiam izoftalata acido uzatas en produktado de rezinoj plastaj boteloj por trinkaĵoj. La altplenuma polimero, poli-benzimidazolo estas produktata ekde izoftalata acido. Ankaŭ, la acido uzatas kiel grava krudmaterialo en la produktado de izolado-materialoj.
Izomeroj
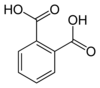
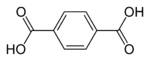
[redakti | redakti fonton]Izoftalata acido estas unu el la tri izomeroj de la benzenokarboksilata acido, estante aliaj la ftalata acido kaj la tereftalata acido.
|

|
|
| ftalata acido | izoftalata acido | tereftalata acido |
| (orto-ftalata acido) | (meta-ftalata acido) | (para-ftalata acido) |
Literaturo
[redakti | redakti fonton]- The Chemical Company Arkivigite je 2015-12-08 per la retarkivo Wayback Machine
- Chemicalland21
- NIST National Institute of Standards and Technology
- Sigma Aldrich
- Cameo Chemicals
- Acta Crystallographica
- De Gruyter
Vidu ankaŭ
[redakti | redakti fonton]Referencoj
[redakti | redakti fonton]- ↑ Chemicalland21
- ↑ Handbook of Fiber Science and Technology Volume 2: High Technology ..., Parte 3, Menachem Lewin, Jack Preston






![{\displaystyle {\mathsf {{\xrightarrow[{}]{H_{2}SO_{4}}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a91dd08456a5acd28298697e8e92c1123b59ed37)