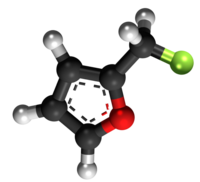
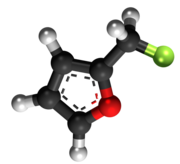
Furfurila klorido
| Furfurila klorido | |||
| Kemia formulo | |||
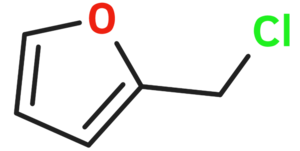 | |||
Furfurila klorido | |||
 | |||
| Alternativa(j) nomo(j) | |||
| |||
| CAS-numero-kodo | 617-88-9 | ||
| ChemSpider kodo | 190292 | ||
| PubChem-kodo | 219520 | ||
| Fizikaj proprecoj | |||
| Aspekto | senkolora likvaĵo | ||
| Molmaso | 100,545 g mol−1 | ||
| Denseco | 1,166 g/cm−3[1][2] | ||
| Fandpunkto | -33°C [3] | ||
| Bolpunkto | 138,95°C [4] | ||
| Refrakta indico | 1,4941[5] | ||
| Ekflama temperaturo | 37,8°C [6][7] | ||
| Solvebleco | Akvo:Malmulte solvebla Solvebla en alkoholo, etero kaj benzeno. | ||
| Mortiga dozo (LD50) | >175 mg/kg (buŝe) | ||
| GHS etikedigo de kemiaĵoj | |||
| GHS Damaĝo Piktogramo |
| ||
| GHS Signalvorto | Averto | ||
| GHS Deklaroj pri damaĝoj | H315, H319, H335 | ||
| GHS Deklaroj pri antaŭgardoj | P261, P264, P264+265, P271, P280, P302+352, P304+340, P305+351+338, P319, P321, P332+317, P337+317, P362+364, P403+233, P405, P501 | ||
(25 °C kaj 100 kPa) | |||
Furfurila klorido aŭ 2-klorometilfurano estas neorganika kombinaĵo apartenanta al la familio de la kloridoj, rezultanta el interagado de la furfurila alkoholo kaj klorida acido. Furfurila klorido estas senkolora likvaĵo kaj solvebla en akvo. Furfurila klorido prezentas unu kloran jonon ligitajn al metilfurano. Ĝi konsistas je 1 grupo metilfurana, 1 kloratomo, kaj uzatas en kemiaj sintezoj. Furfurila klorido estas brulema kiam eksponate al varmo aŭ flamo. Ĝi prezentas danĝeron dum stokado. 2-Klorometilfruano malkomponiĝas sub media temperaturo por liberigi kloridan acidon, kaj povas eksplodi en hermetika ujo. Tre eksplodema kiam ŝokita, eksponita al varmo, aŭ per spontanea kemia reakcio. Ĝi povas vigle reakcii kun oksigenaj materialoj.[8]
Halogenidaj furanoj estas malstabilaj kunmetaĵoj, kiuj malkomponiĝas sub stokado. Rekta halogenado por doni monohalogenido-furanajn derivaĵojn estas malfacile. Halogenidaj furanoj estas akiritaj per senkarboksiligo de la taŭga halogenida-furana karboksilata acido kaj reakcio de klorohidrargo-furanoj kun jodo. La monohalogenidoj estas senkoloraj likvaĵoj kun dolĉaj odoroj kaj estas tre solveblaj en akvo. La karbon-halogena ligilo en halogenida furano estas sufiĉe stabila kaj ne estas anstataŭata per la kutimaj nukleofiloj. Tiu reakcio, aliflanke, okazas kiam la halogenidatomo estas alkroĉita al la flankĉeno tiel kiel en 2-(klorometil) furano.[9]
Reakcioj
[redakti | redakti fonton]Reakcio 1
[redakti | redakti fonton]- Preparado de furfurila klorido per traktado de furfurila alkoholo kun klorida acido
Reakcio 2
[redakti | redakti fonton]- Preparado de furfurila klorido per traktado de klorida acido kun furfurila karbonato:
Reakcio 3
[redakti | redakti fonton]- Preparado de furfurila klorido per traktado de baria klorido kun furfurila benzoato:
Reakcio 4
[redakti | redakti fonton]- Preparado de furfurila klorido per traktado de kloro kun metilfurano:
Reakcio 5
[redakti | redakti fonton]- Preparado de furfurila klorido per traktado de ferika klorido kun metilfurano:
Vidu ankaŭ
[redakti | redakti fonton]Referencoj
[redakti | redakti fonton]- ↑ GuideChem
- ↑ Chemindex
- ↑ EPA United States Environmental Protection Agency
- ↑ Chemsrc
- ↑ Chemical Book. Arkivita el la originalo je 2022-12-18. Alirita 2022-12-18 .
- ↑ Chemnet
- ↑ Chembk
- ↑ [https://www.buyersguidechem.com/chemical_supplier/2-(Chloromethyl)furan Guidechem
- ↑ Heterocyclic Chemistry






![{\displaystyle {\mathsf {{\xrightarrow[{}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/af21b07e9e503bdbbee6814c136975f68f374663)