Perjodata acido
| Perjodata acido | |||||
| |||||
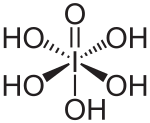
| Kemia strukturo de la Orto-perjodata acido aŭ H5IO6 | |||||
 
| |||||
| Kemia strukturo de la Meta-perjodata acido aŭ HIO4 | |||||
| GHS-piktogramoj por brulivaj kaj korodaj substancoj | |||||
| Kemia formulo |
| ||||
| CAS-numero-kodo | 10450-60-9 | ||||
| ChemSpider kodo | |||||
| PubChem-kodo | |||||
| Fizikaj proprecoj | |||||
| Aspekto | Senkoloraj kristaloj | ||||
| Molmaso |
| ||||
| Smiles |
| ||||
| Denseco | 1.4 kg/m3 g/cm3 (ortoperiodata acido) | ||||
| Fandopunkto | 128.5 °C (263.3 ℉; 401.6 K)[1] | ||||
| Solvebleco |
| ||||
| Sekurecaj Indikoj | |||||
| Risko | R8 R23 R24 R25 R34 R41 | ||||
| Sekureco | S26, S36/37/39, S45 | ||||
| Pridanĝeraj indikoj | |||||
| Danĝero
| |||||
| GHS etikedigo de kemiaĵoj[1] | |||||
| GHS Damaĝo-piktogramo |
| ||||
| GHS Signalvorto | Damaĝo | ||||
| GHS Deklaroj pri damaĝoj | H272, H314 | ||||
| GHS Deklaroj pri antaŭgardoj | P210, P221, P260, P264, P280, P301+330+331, P303+361+353, P304+340, P305+351+338, P310, P363, P405, P501 | ||||
(25 °C kaj 100 kPa) | |||||
Perjodata acido, Perjodato de hidrogeno estas oksoacido de jodo kun plej alta oksidiĝa nombro +7. Kiel ĉiuj perjodatoj, ĝi ekzisteblas laŭ du formoj: ortoperjoda acido aŭ H5IO6 kun oksidiĝa nombro kaj metaperjodata acido aŭ HIO4. Perjodata acido estis malkovrita en 1833 de Heinrich Gustav Magnus (1802-1870) kaj Carl Friedrich Ammermüller, patro de samnoma kuracisto Friedrich Ammermüller (1809-1898).
Perjodata acido posedas acidajn proprecojn similajn al tiuj de la perklorata acido. Ĝia solvaĵo eblas boli sen malkomponiĝo, kaj sub vaporigo la acido estigas acidajn kristalojn, kiuj estas tre stabilaj sub aera ekspozicio. Kiam varmigita supera ol 212 °C, perjodata acido perdas oksigenon kaj jodata acido restas. Tiamaniere ke perjodata acido estas pli facila malkomponiĝi ol jodata acido[2].
Sintezo
[redakti | redakti fonton]Perjodata acido estis unue produktita, en 1833, per reakcio inter "arĝenta perjodato" kaj malvarma akvo:
Perjodata acido estas malforta acido tamen ĝi prezentas fortajn oksidigajn proprecojn. Kiam varmigita perjodata acido disproporciiĝas en dujoda kvinoksido, jodo kaj akvo.
Perjodata acido prepareblas per reakcio inter la perklorata acido kaj jodo:
2 НСlО4 + I2 → 2 НIO4 + Cl2↑
Reakcioj
[redakti | redakti fonton]La saloj de perjodata acido estas fortaj oksidigagentoj; kiam varmigitaj ili malkomponiĝas per liberigo de oksigeno.
Perjodatoj prepareblas per oksidado en alkala medio ekde natria jodato pere de forta oksidanto tiel kiel kloro:
Ortoperjodata acido havas sennombrajn Konstanto pri dissociigo de acidoj aŭ pKa. La pKa de la metaperjodata acido neniam estis determinita:
H5IO6 ↔ H4IO6− + H+, pKa = 3.29
H4IO6− ↔ H3IO62− + H+, pKa = 8.31
H3IO62− ↔ H2IO63− + H+, pKa = 11.60
Mineralaj acidoj
[redakti | redakti fonton]| Halogenidaj acidoj | |||||||
| HF | Fluorida acido | HCl | Klorida acido | HBr | Bromida acido | HI | Jodida acido |
| HFO | Hipofluorita acido | HClO | Hipoklorita acido | HBrO | Hipobromita acido | HIO | Hipojodita acido |
| HFO2 | Fluorita acido | HClO2 | Klorita acido | HBrO2 | Bromita acido | HIO2 | Jodita acido |
| HFO3 | Fluorata acido | HClO3 | Klorata acido | HBrO3 | Bromata acido | HIO3 | Jodata acido |
| HFO4 | Perfluorata acido | HClO4 | Perklorata acido | HbrO4 | Perbromata acido | HIO4 | Perjodata acido |
Literaturo
[redakti | redakti fonton]- A Text Book of Inorganic Chemistry, Anil Kumar De
- Ionic Equilibria in Analytical Chemistry, Jean-Louis Burgot
- Gardner's Commercially Important Chemicals: Synonyms, Trade Names, and ..., G. W. A. Milne
- Electrochemical Science and Technology of Copper: Proceedings of the ..., P. Vanýsek
- Theory and Practice of Histological Techniques, John D. Bancroft, Marilyn Gamble
- Handbook of Phycological Methods: Physiological And Biochemical ..., Volume 2, Janet R. Stein, Johan A. Hellebust, J. S. Craigie
- Atlas of Clinical Hematology, Helmut Löffler, Johann Rastetter, Torsten Haferlach, L. Heilmeyer, H. Begemann
- Oraganic Name Reactions Reagents and Molecular Rearrangements
- Ionic Equilibria in Analytical Chemistry, Jean-Louis Burgot
- Wheat: Chemistry and Utilization, Hugh Cornell, Albert W. Hoveling
Referencoj
[redakti | redakti fonton]- ↑ Αlfa Aesar[rompita ligilo]
- ↑ Elements of Chemistry Including in the History of the Imponderables and the ..., Edward Turner










