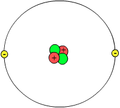
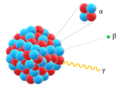
Atomo

Atomo (de la greka vorto ἄτομος [atomos] = "netranĉebla") estas, en filozofio kaj poste fiziko, baza ero kiu konsistigas materion.
Priskribo
[redakti | redakti fonton]Atomoj kaj iliaj konsistigaj partikloj
[redakti | redakti fonton]La materio estas elfarita el atomoj, kaj dum tre longa tempo oni kredis, ke atomoj estis vere nedisigeblaj. Tamen, hodiaŭ oni scias, ke atomoj estas elfaritaj el tri diversaj partikloj: protonoj, elektronoj, kaj neŭtronoj. Protonoj kaj elektronoj estas tiel nomitaj ĉar ili estas la plej malgrandaj stabilaj partikloj kun pozitivaj kaj negativaj elektraj ŝargoj, respektive. Neŭtronoj estas la plej pezaj barionoj sen elektra ŝargo kaj nur stabilaj en la atomkerno pro la nuklea forto. Protonoj kaj neŭtronoj formas la centron de la atomo kaj havas plejparton de la maso, dum elektronoj ŝvebas ĉirkaŭ la centro.
Elektra neŭtreco de atomoj
[redakti | redakti fonton]Atomoj estas kutime elektre neŭtraj, ĉar ili havas saman kvanton da protonoj kaj elektronoj. Ĉi tiu ekvilibro inter pozitivaj kaj negativaj ŝargoj certigas la stabilecon de la atomo.
Protonoj kaj neŭtronoj en la atomo
[redakti | redakti fonton]Atomoj povas havi malsamajn nombrojn de protonoj, kio determinas la ecojn de la elemento. Atomoj kun la sama nombro de protonoj (notita "Z") apartenas al la sama kemia elemento. Tamen, atomoj de la sama elemento povas havi malsaman nombron de neŭtronoj (notita "N"), kio kreas izotopojn. Atomoj kun pli malmultaj protonoj kutime havas proksimume egalan nombron de neŭtronoj kaj protonoj, dum atomoj kun pli grandaj nombroj da protonoj bezonas eĉ pli da neŭtronoj por resti stabilaj (Vd la apudan bildon).
Molekuloj kaj kemiaj ligoj
[redakti | redakti fonton]La elementoj povas kuniĝi por formi molekulojn. Ekzemple, ordinara molekulo estas akvo (H2O), kiu konsistas el du atomoj de hidrogeno kaj unu atomo de oksigeno. Molekuloj estas la bazaj konstruaĵoj de multaj substancoj, kiujn ni vidas ĉiutage.
Grandeco de atomoj
[redakti | redakti fonton]Atomoj estas tiel malgrandaj, ke ili ne videblas eĉ per elektrona mikroskopo. Ekzemple, la grandeco de hidrogenatomo estas nur 0,1 nanometro, aŭ 1/100.000.000.000 metroj (10−10 m). Por pli konkreta ilustraĵo, unu gramo da aluminio enhavas proksimume 20.000.000.000.000.000.000.000 atomojn (2x1022).
Historio de malkovroj
[redakti | redakti fonton]
La greka filozofo Demokrito unue tezis, ĉirkaŭ la jaro 400 a.K., ke devas ekzisti nedivideblaj eroj de materio, aŭ elementoj. Li nomis ĉi tiujn malgrandegajn erojn de materio "atomos", vorto kiu en la greka signifis "netranĉebla". Tamen, hodiaŭ oni scias, ke la atomo vere estas dividebla.
La atommodelo de Thomson estas unu el la pluraj sciencaj modeloj de la atomo. Ĝi estis unue proponita de Joseph John Thomson en 1904[1] rapide post la malkovro de la elektronoj, sed antaŭ la malkovro de la atomkerno. La modelo provis kombini la tiame konatajn ecojn de atomoj: 1) elektronoj estas negative ŝargitaj partikloj kaj 2) atomoj estas neŭtre ŝargitaj.
La "planeda modelo" diris, ke la atomo pli-malpli similas la sunsistemon; la kerno similas la sunon, kaj la elektronoj similas la ĉirkaŭantajn planedojn. Hodiaŭ oni scias, ke la elektronoj ŝvebas ĉirkaŭ la centro ne kiel planedoj, sed laŭ malsimplaj orbitoj determinitaj per la Ekvacio de Ŝrodinger.
Atommodeloj
[redakti | redakti fonton]Modelo de Dalton
[redakti | redakti fonton]La modelo de Dalton estis la unua atoma modelo kiu uzis sciencajn bazojn, kaj estis formulita en 1803 de John Dalton, kiu imagis la atomojn kiel malgrandajn sferojn.[2] Tiu unua atoma modelo postulis jenon:
- La materio estas formata per tre malgrandaj partikloj nomataj atomoj, kiuj estas nedivideblaj kaj nedetrueblaj.
- La atomoj de unu elemento estas egalaj inter si, havas propran pezon kaj proprajn kvalitojn. La atomoj de la diversaj elementoj havas malsamajn pezojn.
- La atomoj restas nedividataj, eĉ kombinataj en la kemiaj reagoj.
- La atomoj, se kombinataj por formi komponaĵojn konservas simplajn rilatojn.
- La atomoj de diferencaj elementoj estas kombineblaj en diferencaj proporcioj kaj povas formi pli ol unu komponaĵo.
- La kemiaj komponaĵoj estas formataj kiam unuiĝas atomoj de du aŭ pliaj diversaj elementoj.
Modelo de Thomson
[redakti | redakti fonton]La atommodelo de Thomson estas unu el la pluraj sciencaj modeloj de la atomo. Ĝi estis unue proponita de Joseph John Thomson en 1904[1] rapide post la malkovro de la elektrono, sed antaŭ la malkovro de la atomkerno. La modelo provis kombini la tiame konatajn ecojn de atomoj: 1) elektronoj estas negative ŝargitaj partikloj kaj 2) atomoj estas neŭtre ŝargitaj. Tiele la elektronoj estas supozataj dronigitaj en pozitiva "supo" kiel prunoj (angle plum) en pudingo (angle pudding), sekvas la imaga nomo de tia "plum pudding modelo".
Modelo de Nagaoka
[redakti | redakti fonton]Hantaro Nagaoka malakceptis la modelon de Thomson, ĉar la ŝargoj ne estas penetreblaj de siaj kontraŭoj. Pro sia malkonsento kun la tiama modelo, en 1904 li proponis alternativan modelon, en kiu la centro de pozitiva ŝargo estis ĉirkaŭata de nombraj elektronoj kiuj turnis, farante similan bildon al tiu de la planedo Saturno kun ĝiaj ringoj, surbaze de la teorioj kiuj klarigis la stabilecon kaj la gravitajn rilatojn inter la planedo kaj ĝiaj ringoj. La tezo estis jena: la ringoj estas stabilaj, ĉar la planedo kiun ili estas ĉirkaŭanta estas tre masiva.
Modelo de Rutherford
[redakti | redakti fonton]
En 1911, Ernest Rutherford proponis modelon de atomo kun pozitiva kerno, en kiu koncentriĝas la preskaŭ tuta maso de l'atomo, ĉirkaŭ orbitas negativaj elektronoj, tiel ke la atomo estas elektre neŭtra.
La atoma modelo de Rutherford[3] estas modelo de la interna strukturo de atomo proponita de la brit-nov-zelanda apotekisto kaj fizikisto Ernest Rutherford[4] en 1911, por klarigi la rezultojn de sia "eksperimento pri orfolio". Rutherford konkludis, ke la maso de atomo estis koncentrita en malgranda regiono de pozitivaj ŝargoj kiuj malhelpis la trairejon de pozitivaj alfa-partikloj. Li poste proponis novan modelon, kiu havis nukleon aŭ centron kie la atommodelo de Thomson ne povis klarigi kiel la ŝargo sur la elektronoj povas esti konservita ene de la atomo. Li ankaŭ ne povis klarigi la stabilecon de atomo. Lia teorio menciis nenion pri la kerno de la atomo; la maso kaj pozitiva ŝargo estas koncentritaj en ĝi, kaj la negative ŝargitaj elektronoj troviĝas en la eksternuklea zono.
Modelo de Bohr
[redakti | redakti fonton]La modelo de Bohr estas malnoviĝinta teorio en la kampo de fiziko/kemio, serĉante kompreni la konsiston de atomo, kaj pli precipe de hidrogeno kaj hidrogenaj jonoj (jonoj posedataj de ununura elektrono). Evoluigita fare de Niels Bohr en 1913 tiu teorio establita sur la "planeda modelo" de Rutherford renkontis tujan sukceson kiam ĝi klarigis en simpla maniero la spektrajn intervalojn de hidrogenelementoj, tiel establante proksimiĝon inter la unuaj modeloj de la atomo kaj la teorio de kvantuma mekaniko.
Tiu nova modelo en kiu la elektronoj de atomo supozevle orbitas la nukleon, sed povis fari tion nur en finia serio de orbitoj, kaj povis salti inter tiuj orbitoj nur en diskretaj ŝanĝoj de energio korespondaj al la absorbo de radiado de fotono.[5] Tiun kvantumadon oni uzis por klarigi kial la orbitoj de la elektronoj estas stabilaj kaj kial elementoj absorbas kaj elsendas elektromagnetan radiadon en diskretaj spektroj.[6]
Tiu modelo estis ĝeneraligita al la kazo de relativecaj elektronoj fare de Arnold Sommerfeld skribante kvante la fajnan strukturon de la spektraj linioj de hidrogeno. Tamen, tiu teorio ne povas klarigi la spektron de multoblaj elektronoj (kiel ekzemple pri heliumo), nek la naturon de kemiaj reakcioj, kaj ĝi tute abandoniĝis pro la avantaĝoj de la kvantuma mekaniko ekde 1925.
Modelo de Sommerfeld
[redakti | redakti fonton]La atoma modelo de Bohr funkciis tre bone por la atomo de hidrogeno, tamen, en la spektroj faritaj por atomoj de aliaj elementoj estis observite ke elektronoj de la sama energinivelo havis malsamajn energiojn, montrante ke ekzistas eraro en la modelo. Lia konkludo estis, ke ene de la sama energinivelo estis subniveloj, tio estas, iomete malsamaj energioj. Krome, el teoria vidpunkto, Sommerfeld trovis, ke en kelkaj atomoj la rapidoj de la elektronoj atingis konsiderindan frakcion de la lumrapido. Sommerfeld studis la esploradon pri relativecaj elektronoj.
La germana fizikisto Arnold Sommerfeld, kun la helpo de la teorio de la relativeco de Albert Einstein, faris la sekvajn modifojn al la modelo de Bohr:
- Elektronoj moviĝas ĉirkaŭ la nukleo, en cirklaj aŭ elipsaj orbitoj.
- Komencante de la dua energinivelo, ekzistas du aŭ pli da subniveloj sur la sama nivelo.
- La elektrono estas eta elektra kurento.
Sekve, la atommodelo de Sommerfeld estas ĝeneraligo de la atommodelo de Bohr el la relativeca vidpunkto, kvankam li ne povis pruvi la formojn de emisio de elipsaj orbitoj, li nur ekskludis ilian cirklan formon.
Modelo de Schrödinger
[redakti | redakti fonton]
Post kiam Louis-Victor de Broglie proponis la ondnaturon de materio en 1924, kiu estis ĝeneraligita fare de Erwin Schrödinger en 1926, la modelo de la atomo denove estis ĝisdatigita.
En la modelo de Schrödinger, la koncepto de elektronoj kiel etaj ŝarĝitaj sferoj kiuj rondiras ĉirkaŭ la nukleo estas prirezignita, kio estas ekstrapolo de sperto je makroskopa nivelo al la eta grandeco de la atomo. Anstataŭe, Schrödinger priskribas elektronojn per ondofunkcio, kies kvadrato reprezentas la probablecon de ilia ĉeesto en limigita regiono de spaco. Ĉi tiu probabla zono estas konata kiel orbitalo. La grafikaĵo malsupre montras la orbitalojn por la unuaj energiniveloj disponeblaj en la hidrogena atomo.
Modelo de Dirac
[redakti | redakti fonton]La Diraka ekvacio aspektas tiel:
kie m estas kvietmaso de la elektrono, c estas lumrapideco, p estas la momanta operatoro, estas la reduktita konstanto de Planck, x kaj t estas, respektive, la spaca kaj tempa koordinatoj, kaj ψ(x, t) estas kvar-komponanta ondfunkcio. En 1928, la relativeca modelo de Dirac anstataŭas la tro simplan "planedan modelon" de atomo per inkludo de ondfunkcioj al la videbloj (pozicio, movkvanto...) de atomelektronoj.
La α-oj estas linearaj operatoroj, kiuj agas en la ondfunkcio. Ilia plej fundamenta eco estas ke ili estu kontraŭkomutaj. En aliaj vortoj,
- ,
kie , kaj i kaj j estas inter nulo kaj tri. La plej simpla maniero por ricevi tiajn ecojn estas per 4×4 matricoj. Ne ekzistas aro de matricoj kun pli malgranda dimensio, kiu verigus la postulon de kontraŭkomuteco. Tiuj kvar-dimensiaj matricoj nomiĝas α-matricoj de Dirako:
Oportuna (sed ne unika) elekto de -matricoj estas
- ,
- ,
La Diraka ekvacio priskribas la probablecajn amplitudojn por sola elektrono. Ĝi estas sola-partikla teorio, en aliaj vortoj, ĝi ne aplikas la kreadon kaj detruadon de la partikloj. Ĝi donas bonan antaŭdiron por la magneta momanto de elektrono kaj klarigas fajnan strukturon observeblan en atomaj spektraj linioj. Ĝi ankaŭ eksplikas la spinon de la elektrono. Du de la kvar solvoj de la ekvacio konformas al du spinaj ŝtatoj de elektrono. La aliaj du solvoj sugestas, ke ekzistas malfinia aro da kvantumaj statoj, en kiuj la elektrono havas negativan energion. Ĉi tiu stranga rezulto gvidis Dirakon al konkludo, tra rimarkinda hipotezo sciata kiel "trua teorio", ke ekzistas pozitive ŝargitaj "elektronoj". Ĉi tiu antaŭdiro estis pruvita per malkovro de pozitronoj en 1932 (antaŭe nomitaj pozitonoj kiel elektronoj estis nomitaj negatonoj).
Strukturo
[redakti | redakti fonton]Subatomaj partikloj
[redakti | redakti fonton]Kvankam la vorto atomo origine indikis partiklon kiu ne povas esti disigita en pli malgrandajn partiklojn, en moderna scienca uzokutimo la atomo estas kunmetita de diversaj subatomaj partikloj. La konsistigaj partikloj de atomo estas la elektrono, la protono kaj la neŭtrono.
La elektrono estas la malplej masa el tiuj partikloj laŭ kvar ordoj de magnitudo je 9.11×10−31 kg, kun negativa elektra ŝargo kaj grando kiu estas tro malgranda kaj malebligas esti mezurita uzante la disponeblaj teknikoj.[7] Ĝi estis la plej malpeza partiklo kun pozitiva restanta maso mezurita, uzante la malkovron de la neŭtrinan mason. Je ordinaraj kondiĉoj, elektronoj estas ligitaj al la pozitive ŝarĝita nukleo pere de la alligiteco kreita el la opoziciaj elektraj ŝarĝoj. Se atomo havas pli aŭ malpli da elektronoj ol ties atoma nombro, tiam ĝi iĝas respektive negative aŭ pozitive ŝarĝita kiel tuto; ŝarĝita atomo estas nomita jono. Elektronoj estis konata ekde la fino de la 19-a jarcento, ĉefe pro J.J. Thomson.
Protonoj havas pozitivan ŝarĝon kaj mason de 1.6726×10−27 kg. La nombro de protonoj en atomo estas nomita ĝia atoma nombro. Ernest Rutherford (1919) observis, ke nitrogeno sub alfa-partikla bombardado elsendas tion kio ŝajnas hidrogenaj nukleoj. Ĉirkaŭ 1920 li estis akceptinta, ke la hidrogena nukleo estas diferenca partiklo ene de la atomo kaj nomis ĝin protono.
Neŭtronoj ne havas elektran ŝarĝon kaj havas mason de 1.6749×10−27 kg.[8][9] Neŭtronoj estas la plej pezaj el la tri konstituantaj partikloj, sed ilia maso povas esti reduktita pere de la nuklea ligenergio. Neŭtronoj kaj protonoj (kolektive konataj kiel nukleonoj) havas kompareblajn dimensiojn — ĉirkaŭ 2.5×10−15 m— kvankam la 'surfaco' de tiuj partikloj neestas klare difinita.[10] La neŭtronon malkovris en 1932 la angla fizikisto James Chadwick.
En la Norma modelo de fiziko, elektronoj estas veraj elementaj partikloj sen interna strukturo, dum protonoj kaj neŭtronoj estas partikloj komponitaj de elementaj partikloj nomitaj Kvarkoj. Estas du tipoj de kvarkoj en atomoj, el kiuj ĉiuj havas frakcian elektran ŝarĝon. Protonoj estas komponitaj de du U-kvarkoj (el kiuj ĉiuj kun ŝarĝo + 2/3 kaj unu D-kvarko (kun ŝarĝo de −1/3). Neŭtronoj konsistas de unu U-kvarko kaj de du D-kvarkoj. Tiu distingo klarigas la diferencon en amaso kaj ŝarĝo inter ambaŭ partikloj.[11][12]
La kvarkoj estas tenitaj kune per la forta interagado (aŭ forta forto), kiu estas mediaciita per gluonoj. La protonoj kaj neŭtronoj, siavice, estas tenataj unu al la alia en la nukleo per la nuklea forto, kiu estas restaĵo de la forta forto kiu havas iom malsamajn interval-propraĵojn (vidu la artikolon pri la nuklea forto por plia informo). La gluono estas membro de la familio de gaŭĝaj bosonoj, kiuj estas elementaj partikloj kiuj peras fizikajn fortojn.[11][12]
Nukleo
[redakti | redakti fonton]
Ĉiuj ligitaj protonoj kaj neŭtronoj en atomo konsistigas etan atomkernon, kaj estas kolektive nomitaj nukleonoj. La radiuso de nukleo estas proksimume egala al femtometroj, kie estas la totala nombro de nukleonoj.[13] Tio estas multe pli malgranda ol la radiuso de la atomo, kiu estas ĉirkaŭ 105 fm. La nukleonoj estas kunligitaj per mallongdistance alloga potencialo nomita la restanta forta forto. Je distancoj pli malgrandaj ol 2.5 fm tiu forto estas multe pli potenca ol la elektrostatika forto kiu igas pozitive ŝargitajn protonojn por forpuŝi unu la alian.[14]
Atomoj de la sama elemento havas la saman nombron da protonoj, nomataj atomnombro. Ene de ununura elemento, la nombro da neŭtronoj povas varii, determinante la izotopon de tiu elemento. La totala nombro de protonoj kaj neŭtronoj determinas la nuklidon. La nombro da neŭtronoj relative al la protonoj determinas la stabilecon de la nukleo, kaj certaj izotopoj spertas radioaktivan disfalon.[15]
La protono, la elektrono kaj la neŭtrono estas klasifikitaj kiel fermionoj. Fermionoj obeas la Pauli-ekskludprincipon, kiu malpermesas identajn fermionojn, kiel ekzemple multoblaj protonoj, de okupado de la sama kvantuma stato en la sama tempo. Tiel, ĉiu protono en la nukleo devas okupi kvantuman staton malsaman de ĉiuj aliaj protonoj, kaj la samo validas por ĉiuj neŭtronoj de la nukleo kaj por ĉiuj elektronoj de la elektrona nubo.[16]
Nukleo kiu havas malsaman nombron da protonoj ol neŭtronoj povas eble fali al pli malalta energistato tra radioaktiva disfalo, kiu igas la nombron da protonoj kaj neŭtronoj pli proksime egaligitaj. Kiel rezulto, atomoj kun egalaj nombroj de protonoj kaj neŭtronoj estas pli stabilaj kontraŭ kadukiĝo, sed kun kreskanta atomnombro, la reciproka repuŝo de la protonoj postulas kreskantan proporcion de neŭtronoj por konservi la stabilecon de la nukleo.[16]

La nombro da protonoj kaj neŭtronoj en la atomkerno povas esti modifita, kvankam tio povas postuli tre altajn energiojn pro la forta forto. Nuklea fuzio okazas kiam multoblaj atompartikloj kuniĝas por formi pli pezan nukleon, kiel ekzemple tra la energia kolizio de du nukleoj. Ekzemple, ĉe la kerno de la Suno protonoj postulas energiojn de 3 ĝis 10 keV por superi sian reciprokan repuŝon - la kulomban baron - kaj kunfandiĝi en ununuran nukleon.[17] Nuklea fisio estas la kontraŭa procezo, igante nukleon fendetiĝi en du pli malgrandajn nukleojn - kutime tra radioaktiva disfalo. La nukleo ankaŭ povas esti modifita per bombardado per altenergiaj subatomaj partikloj aŭ fotonoj. Se tio modifas la nombron da protonoj en nukleo, la atomo ŝanĝiĝas al malsama kemia elemento.[18][19]
Se la maso de la nukleo sekvanta fuzioreagon estas malpli ol la sumo de la masoj de la apartaj partikloj, tiam la diferenco inter ĉi tiuj du valoroj povas esti elsendita kiel speco de uzebla energio (kiel ekzemple gamaradio, aŭ la kinetika energio de beta-partiklo), kiel priskribite per la masenergia ekvivalenta formulo de Albert Einstein, E=mc2, kie m estas la perdorapideco kaj c estas la lumrapideco. Tiu deficito estas parto de la ligiga energio de la nova nukleo, kaj estas la nereakirebla perdo de la energio, kiu igas la kunfanditaj partikloj resti kune en stato kiu postulas, ke tiu energio apartiĝu.[20]
La fuzio de du nukleoj kiuj kreas pli grandajn nukleojn kun pli malaltaj atomnombroj ol fero kaj nikelo - totala nukleona nombro de proksimume 60 - estas kutime ekzoterma procezo, kiu elsendas pli da energio ol estas postulata por kunigi ilin.[21] Estas ĉi tiu energi-elsenda procezo kiu faras nuklean fuzion en steloj memsubtena reago. Por pli pezaj nukleoj, la ligiga energio por nukleono komencas malpliiĝi. Tio signifas ke fuzioprocezo produktanta nukleon kiu havas atomnombron pli altan ol proksimume 26, kaj masnombron pli altan ol proksimume 60, estas endoterma procezo. Tiel, pli masivaj nukleoj ne povas sperti energiproduktantan fuzioreakcion kiu povas elteni la hidrostatikan ekvilibron de stelo.[16]
Elektrona nubo
[redakti | redakti fonton]
La elektronoj en atomo estas altiritaj al la protonoj en la nukleo fare de la elektromagnetika forto. Tiu forto ligigas la elektronojn ene de elektrostatika potenciala puto ĉirkaŭ la plej malgranda nukleo, kio signifas, ke ekstera forto de energio estas necesa por ke la elektrono foriru. Ju pli proksime elektrono estas al la nukleo, des pli granda estas la altira forto. Tial elektronoj ligiĝas proksime de la centro de la potenciala puto postulas pli da energio por eskapi ol tiuj ĉe pli grandaj apartigoj.
Elektronoj, kiel aliaj partikloj, havas proprecojn kaj de partiklo kaj de ondo. La elektrona nubo estas regiono ene de la potenciala puto, kie ĉiu elektrono formas specon de tridimensia konstanta ondo - ondoformo kiu ne moviĝas relative al la nukleo.

Ĉi tiu konduto estas difinita per atomorbitalo, matematika funkcio kiu karakterizas la probablecon ke elektrono ŝajnas esti en aparta loko kiam ĝia pozicio estas mezurita.[22]> Nur diskreta (aŭ kvantigita) aro de tiuj orbitaloj ekzistas ĉirkaŭ la nukleo, ĉar aliaj eblaj ondopadronoj rapide kadukiĝas en pli stabilan formon.[23] Orbitaloj povas havi unu aŭ plurajn ringajn aŭ nodajn strukturojn, kaj diferenci unu de la alia laŭ grandeco, formo kaj orientiĝo.[24]
Ĉiu atomorbitalo egalrilatas al speciala energinivelo de la elektrono. La elektrono povas ŝanĝi sian staton al pli alta energinivelo absorbante fotonon per sufiĉa energio por akceli ĝin en la novan kvantuman staton. Same, per spontanea eligo, elektrono en pli alta energistato povas fali al pli malalta energistato, dum radiado de la troa energio kiel fotono. Ĉi tiuj karakterizaj energivaloroj, difinitaj per la diferencoj en la energioj de la kvantumaj statoj, respondecas pri atomaj spektraj linioj.[23]
La kvanto de energio necesa por forigi aŭ aldoni elektronon - la elektron-liga energio - estas multe malpli ol la liga energio de nukleonoj. Ekzemple, ĝi postulas nur 13.6 eV por senigi bazan staton de elektrono de hidrogenatomo,[25] kompare kun 2.23 milionoj da eV por disigo de nukleo de deŭterio.[26] Atomoj estas elektre neŭtralaj se ili havas egalan nombron da protonoj kaj elektronoj. Atomoj kiuj havas aŭ deficiton aŭ troon de elektronoj estas nomitaj jonoj. Elektronoj kiuj estas plej malproksimaj de la nukleo povas esti transdonitaj al aliaj proksimaj atomoj aŭ dividitaj inter atomoj. Per ĉi tiu mekanismo, atomoj povas ligiĝi en molekulojn kaj aliajn specojn de kemiaj komponaĵoj kiel jonaj kaj kovalentaj retaj kristaloj.[27]
Bildaro
[redakti | redakti fonton]-
Simpla bildigo de heliumoatomo
-
Pudinga modelo de atomo
-
Bildigo de atoma modelo de Rutherford
-
Bildigo de la modelo de Schrödinger pri heliumo
-
La kolorintenso estas proporcia al la probablodenso laŭ la elektronaj orbitaloj
Vidu ankaŭ
[redakti | redakti fonton]- Joniga energio
- Kemia ligo
- Listo de partikloj
- Pozitrono kaj Pozitronio
- Atomkerno
- Nuklido kaj Izotopo
- Atomkerna izomero
- Strukturiĝo de atomoj
- Subatoma partiklo
Referencoj
[redakti | redakti fonton]- ↑ 1,0 1,1 Plum Pudding Model - Universe Today. Universe Today (27-a de aŭgusto 2009). Alirita la 19-an de decembro 2015 .
- ↑ Rincón Arce, Álvaro (1983) ABC de Química Primer Curso, Editorial Herrero, México, ISBN 968-420-294-6.
- ↑ José Manuel Sánchez. (11a de novembro 1993) Espacio, tiempo y atómos. Relatividad y mecánica cuántica (Spaco, tempo kaj atomoj. Relativeco kaj kvantuma mekaniko (hispane). ISBN 9788446001522.
- ↑ Calahorro. Química general. Introducción a la Química Teórica (Ĝenerala kemio. Enkonduko al Teoria Kemio) (hispane).
- ↑ Stern, David P. (16a de Majo 2005). "The Atomic Nucleus and Bohr's Early Model of the Atom". NASA/Goddard Space Flight Center. Arkivita el la originalo la 20an de Aŭgusto 2007.
- ↑ Bohr, Niels (11a de Decembro 1922). "Niels Bohr, The Nobel Prize in Physics 1922, Nobel Lecture". Nobel Foundation. Arkivita el la originalo la 15an de Aprilo 2008.
- ↑ Demtröder, Wolfgang. (2002) Atoms, Molecules and Photons: An Introduction to Atomic- Molecular- and Quantum Physics, 1‑a eldono, Springer, p. [htt://archive.org/details/atomsmolecules00demt_277/e/n51 39]–42. ISBN 978-3-540-20631-6. OCLC 181435713.
- ↑ Woan, Graham. (2000) The Cambridge Handbook of Physics. Cambridge University Press. ISBN 978-0-521-57507-2. OCLC 224032426.
- ↑ Mohr, P.J.; Taylor, B.N. and Newell, D.B. (2014), "The 2014 CODATA Recommended Values of the Fundamental Physical Constants" (el Retarkivo {{{1}}}) (Web Version 7.0). La datumbazon disvolvis J. Baker, M. Douma, kaj Svetlana Kotoĉigova. (2014). National Institute of Standards and Technology, Gaithersburg, Maryland 20899.
- ↑ MacGregor, Malcolm H.. (1992) The Enigmatic Electron. Oxford University Press, p. [htt://archive.org/details/astronomyencyclo0000unse/e/33 33–37]. ISBN 978-0-19-521833-6. OCLC 223372888.
- ↑ 11,0 11,1 Particle Data Group (2002). "The Particle Adventure". Lawrence Berkeley Laboratory. Arkivita el la originalo la 4an de Januaro 2007.
- ↑ 12,0 12,1 Schombert, James (18a de Aprilo 2006). "Elementary Particles". University of Oregon. Arkivita el la originalo la 30an de Aŭgusto 2011.
- ↑ Jevremovic, Tatjana. (2005) Nuclear Principles in Engineering. Springer. ISBN 978-0-387-23284-3. OCLC 228384008.
- ↑ Pfeffer, Jeremy I.. (2000) Modern Physics: An Introductory Text. Imperial College Press, p. 330–336. ISBN 978-1-86094-250-1. OCLC 45900880.
- ↑ Wenner, Jennifer M. (10a de Oktobro 2007). "How Does Radioactive Decay Work?". Carleton College. Arkivita el la originalo la 11an de Majo 2008.
- ↑ 16,0 16,1 16,2 Raymond, David (7a de Aprilo 2006). "Nuclear Binding Energies". New Mexico Tech. Arkivita el la originalo la 1an de Decembro 2002.
- ↑ Mihos, Chris (23a de Julio 2002). "Overcoming the Coulomb Barrier". Case Western Reserve University. Arkivita el la originalo la 12an de Septembro 2006.
- ↑ Staff (30a de Marto 2007). "ABC's of Nuclear Science". Lawrence Berkeley National Laboratory. Arkivita el la originalo la 5an de Decembro 2006.
- ↑ Makhijani, Arjun; Saleska, Scott (2a de Marto 2001). "Basics of Nuclear Physics and Fission". Institute for Energy and Environmental Research. Arkivita el la originalo la 16an de Januaro 2007.
- ↑ Shultis, J. Kenneth. (2002) Fundamentals of Nuclear Science and Engineering. CRC Press, p. 10–17. ISBN 978-0-8247-0834-4. OCLC 123346507.
- ↑ Fewell, M.P. (1995). "The atomic nuclide with the highest mean binding energy". American Journal of Physics. 63 (7): 653–658. Bibcode:1995AmJPh..63..653F. doi:10.1119/1.17828.
- ↑ Mulliken, Robert S. (1967). "Spectroscopy, Molecular Orbitals, and Chemical Bonding". Science. 157 (3784): 13–24. Bibcode:1967Sci...157...13M. doi:10.1126/science.157.3784.13. PMID 5338306.
- ↑ 23,0 23,1 Brucat, Philip J. (2008). "The Quantum Atom". University of Florida. Arkivita el la originalo la 7an de Decembro 2006.
- ↑ Manthey, David (2001). "Atomic Orbitals". Orbital Central. Arkivita el la originalo la 10an de Januaro 2008.
- ↑ Herter, Terry (2006). "Lecture 8: The Hydrogen Atom". Cornell University. Arkivita el la originalo la 22an de Februaro 2012.
- ↑ Bell, R.E.; Elliott, L.G. (1950). "Gamma-Rays from the Reaction H1(n,γ)D2 and the Binding Energy of the Deuteron". Physical Review. 79 (2): 282–285. Bibcode:1950PhRv...79..282B. doi:10.1103/PhysRev.79.282.
- ↑ Smirnov, Boris M.. (2003) Physics of Atoms and Ions. Springer, p. [htt://archive.org/details/ysicsatomsions00smir/e/n262 249]–272. ISBN 978-0-387-95550-6.
Bibliografio
[redakti | redakti fonton]- Teaching Standard Model at high school» (en angla). Kronologio de la atoma modelo.
- Sokolovsky, Silvia (2002). «El Átomo». (en hispana) Arkivita el la originalo en la 5a de Oktobro 2011. Konsultita la 17an de Junio 2021.
- Bransden, B.H.; Joachain, J.C. (1983). Physics of atoms and molecules (en angla). Longman Group Limited. ISBN 0-582-44401-2.
- Cottingham, W.N.; Greenwood, D.A. (2004). An introduction to nuclear physics (en angla). Cambridge University Press. ISBN 0-521-65149-2.
- Demtröder, Wolfgang (2006). Atoms, molecules and photons (en angla). Springer-Verlag. ISBN 978-3-540-20631-6.
- Kramer, Kenneth (1988). Introductory nuclear physics (en angla). ISBN 047180553X.
- «Los ladrillos del Universo: los bloques constituyentes de la materia». Arkivita el la originalo en la 8a de februaro 2009. Disvastiga materialo de la CERN.
Eksteraj ligiloj
[redakti | redakti fonton]- La Aventuro de Partikloj (germane, angle, hispane, france, itale, portugale, norvege, rumane, serbe, ĉine)
- Historio de la modeloj de atomo Arkivigite je 2006-03-05 per la retarkivo Wayback Machine (nederlande)








![{\displaystyle 1.07{\sqrt[{3}]{A}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a74a6ca6998768195969eef75ca046e8431c29d3)