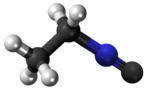
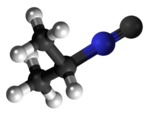
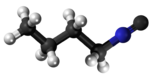
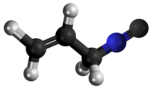
Izonitrilo

Izonitrilo, izocianido aŭ karbilamino estas organikaj komponaĵoj, derivitaj el la "Izocianida acido" aŭ H-N≡C, kaj enhavanta la funkcian grupon -N≡C. La izonitriloj estas izomeroj de la nitriloj; ili estis malkovritaj en 1867, sed neniam trovis larĝaskalan utilon. La izonitrila grupo estas izomero de la nitrila grupo - C≡N, pro tio la prefikso "izo". La organika fragmento konektiĝas al la izocianida grupo pere de la nitrogena atomo, kaj ne pere de la karbono. Ili uzatas kiel konstrublokoj por la sintezo de aliaj kombinaĵoj.
Ĝenerale, la izonitriloj estas preparataj per traktado de la kloroformo kun alkaloj, kaj ofte ili estiĝas kiel flankaj produktoj en la sintezo de nitriloj ekde metalaj cianidoj kaj organikaj halogenidaj komponaĵoj. La hidrogenaj ligoj de la izonitrilaj solvaĵoj estis malkovritaj de Ferrstanding, Paul von Ragué Schleyer (1930-2014) kaj A. Allerhand, en 1962. Publikaĵoj pri la strukturo de la ksantocilino, la unua nature okazanta izocianido, aperis en 1956 kaj 1957 far Ilse Hagedorn (1923-2013) kaj Heinrich Tönjes pluraj jaroj post raporto de Wolfgang Rothe[1] pri la izolo de la "penicillium notatum"[2]. La plejmulto el la maraj izocianidoj estas terpenoidoj, dum kelkaj el la surtera izocianidoj devenas el la aminoacidoj.
Historio
[redakti | redakti fonton]Verdire, la historio de la izonitriloj komencis plurajn jarojn antaŭ ol ilia identigo kiel diskreta klaso da komponaĵoj. Pluraj kemiistoj, provante prepari alkilajn cianidojn ekde la alkila jodido kaj arĝenta cianido aŭ AgCN, izolis konsiderindajn kvantojn da substancoj, kies "horora" odoro ofte rezultis en la fino de la preparadoj.
En 1859, ok jaroj antaŭ ol la apero de la unua laboro de Armand Gautier (1837-1920), W. Lieke reakciis alilan jodidon kaj arĝenta cianido kaj estigis sufiĉan kvanton da likvaĵo kun "penetranta" odoro, kiun li kredis esti la alila cianido. Li provis transformi la hipotezan alilan cianidon en "krotonoata acido" per acida hidrolizo, tamen, li surprizite estigis nur la formiatan acidon. La studoj pri la "anormala" hidroliza reakcio estis "malkontinua pro la konstantaj plendoj de la najbararo pri la naŭxza odoro". Lieke disvolvis ĉiujn siajn eksperimentojn eksterdome pro tio ke "la malfermado de ujo enhavanta la nitrilon ... estis sufiĉa por polui la aeron dum kelkaj tagoj."
Post pluraj jaroj, Viktor Meyer priskribis la "metilan-" kaj "etilan cianidon", kiun li estis kreita per alkiligo de la arĝenta cianido ne rimarkinte ke li estis izolinta la izonitrilojn. Nur post la fundamenta eksperimento de Gaŭtiero ke ĉi tiuj malagrablodoraj komponaĵoj estis konataj kiel la "izomeroj de la ordinaraj nitriloj". Samtempe, August von Hofmann (1818-1892) sintezis plurajn izonitrilojn, inter ili la fenilan izocianidon, reakciante aminojn kun kloroformo kaj kalia hidroksido. Gaŭtier kaj Hofmann komencis longan serion da studoj kiuj daŭxris kelkajn jardekojn pri la apartaj ligoj inter la novaj klasoj de komponaĵoj.
Proprecoj
[redakti | redakti fonton]- Strukturo kaj ligoj
La distanco inter la atomoj N≡C en la izocianidoj estas tre mallonga, 1.158 Å en la metila izocianido. La anguloj C-N-C estas proksimaj al 180°. Samkiel la karbona unuoksido, la izocianidoj priskribiĝas de du resonancaj[3] strukturoj, unu kun triobla ligo inter la nitrogeno kaj la karbono kaj alia kun duobla ligo. Surprize, la dua ligo kun karbenata karaktero (t. e. H2C=) estas pli grava. Tamen, la sola nitrogenaparo, respondeca pri la zwitter jona formulo, stabiligas la strukturon kaj respondecas pri la linieco de la izocianidoj. Izocianidoj estas plej bone prezentataj kvazaŭ miksaĵo da ambaŭaj resonancaj strukturoj kaj ili estas inklinaj al polimerizo.
- Spektroskopio
Izocianidoj elmontras fortan absorbiĝon laŭ ilia Infraruĝa Spektro en la rango de 2165–2110 cm−1.
La elektronika simetrio ĉirkaŭ la izocianida nukleo de la 14N rezultas en malrapida kvarpolara malstreĉiĝo[4], tiamaniere ke la nuklea spinkuplado 13C-14N povas esti observata, kie la kupla konstanto por la 13C nukleo estas proksimume 5 Hz kaj inter 5–14 Hz por la 13C nukleo al kiu la izocianida grupo estas aneksita.
- Odoro
La malagrabla odoro de la izonitriloj estas legenda. Laŭ Lieke, la izocianidoj posedas penetrantan, treege malagrablan odoron; la malfermado de iu flakono enhavanta izocianidon sufiĉas por poluegi la aeron dum kelkaj tagoj. Tamen, ni rimarku ke en la epoko de Lieke, la diferenco inter izocianidoj kaj nitriloj ne estis tre aprecataj.
Ivar Karl Ugi (1930-2005), fakulo, esploristo kaj verkisto pri izonitriloj, iam asertis ke "La disvolviĝo de la izocianida kemio tre multe suferis ... pro la karakteriza odoro de ties volatilaj izonitriloj, kiuj estis priskribitaj de Hofmann kaj Gaŭtier kiel "alte specifa, preskaŭ sveniga, horora kaj ekstreme ĉagrena. Estas vere ke multaj potencaj esploristoj en tiu kampo ne donis kontinuecon al ties laboroj pro la forta odoro. La izocianidoj estas esplorataj kiel potencaj nemortigaj armiloj."
Kelkaj izocianidoj posedas odorojn malpli ofendaj tiel kiel malto, natura kaŭĉuko, kreozoto[5], milda Solanum pseudocapsicum aŭ putra ligno. Ne-volatilaj derivaĵoj tiel kiel "tozilmetila izocianido" ne havas malaprobindajn odorojn.
Tokseco
[redakti | redakti fonton]Dum kelkaj izocianidoj estas toksaj, aliaj prezentas neaprecatajn toksecojn por mamuloj. Rilate al la "etila izocianido", toksologiaj studoj en la jardeko 1960, ĉe Bayer, elmontris ke "buŝaj kaj subhaŭtaj dozoj je 500-5000 mg/kg estas tolereblaj al musoj".
Sintezoj
[redakti | redakti fonton]- Ekde la arĝenta cianido
La unua izocianido, la alila izonitrilo, estis raportata en 1859 de la kemiisto Lieke pere de la reakcio inter la "alila jodido" kaj la "arĝenta cianido". Ĝenerale, la alkiligo de iu alkalometala cianido estigas nitrilon, sed la arĝenta jono protektas la karbonan ekstremaĵon de cianido.
- Ekde formiamidoj
Ordinare, la izocianidoj sintezatas per senhidratigo de la "formiamido". La formiamido estas senhidratigata per "fosfora oksotriklorido", fosgeno aŭ "dufosgeno".
RNHC(O)H + POCl3 → RNC + "PO2Cl" + 2 HCl
- Ekde duklorokarbeno
En la reakcio de la karbilamino, ankaŭ konata kiel Izonitrila Sintezo de Hofmann, la kalia hidroksido reakcias kun la kloroformo por estigi "duklorokarbenon". Tiam ĉi lasta konvertas primaran aminon en izocianidon. Pro tio ke ĝi estas efektiva por la primaraj aminoj, ĉi-reakcio uzatas kiel kemia testo por indiki ties ĉeeston.

- Ekde organolitiaj kombinaĵoj
Ekde reakcio kun la organolitiaj kombinaĵoj pere de oksazoloj kaj benzoksazoloj, laŭ la skemo:

Literaturo
[redakti | redakti fonton]- NCBI Resources
- Isonitrile Chemistry[rompita ligilo], Ivar Ugi
- Isocyanide Chemistry: Applications in Synthesis and Material Science, V. Nenajdenko
- JEE Main Chemistry 2014, MHE
- Studies in Natural Products Chemistry: Bioactive Natural Products (Part L), Atta-ur- Rahman
- Gold Chemistry: Applications and Future Directions in the Life Sciences, Fabian Mohr
- Concise Encyclopedia Chemistry, Mary Eagleson
- Concise Encyclopedia Chemistry
- The New Heart Disease Handbook: Everything You Need to Know to Effectively ..., Christopher P. Cannon M.D.,Elizabeth Vierck
- Click4Tag Arkivigite je 2015-07-02 per la retarkivo Wayback Machine
- Universitato de Kembriĝo Arkivigite je 2015-07-02 per la retarkivo Wayback Machine
- Organic Chemistry
- The misbehaving isonitrile
- Representative works Arkivigite je 2015-07-13 per la retarkivo Wayback Machine
- Slideshare
Vidu ankaŭ
[redakti | redakti fonton]-
Arĝenta cianido -
Cianida acido -
Dufosgeno -
Duklorokarbeno -
Fosfora oksotriklorido -
Ksantocilino -
Tozilmetila izocianido
Referencoj
[redakti | redakti fonton]- ↑ Antibiotics: Origin, Nature and Properties, Tadeusz Korzybski, Zuzanna Kowszyk-Gindifer, Wlodzimierz Kurylowicz.
- ↑ Encyclopaedia Britannica
- ↑ Kemie, resonanco aŭ mezomerismo, estas maniero priskribi la dislokigon de elektronoj ene de certaj molekuloj aŭ pluratomaj jonoj, kie la ligoj ne povas esprimiĝi per unu sola strukturo de Lewis.
- ↑ Fizika malstreĉiĝo ĝenerale signifas la reprenon de iu ekvilibra stato post perturbo de la sistemo.
- ↑ Laŭ PIV, kreozoto estas oleeca, kaŭstika kaj antisepsa substanco, kiun oni produktas per distilado de ligna gudro, uzata en farmacio kaj en industrio.
| ||||