Amonia heksakloro-platenato
| Amonia heksakloroplatenato | ||||

| ||||
| Kemia strukturo de la Amonia heksakloroplatenato | ||||
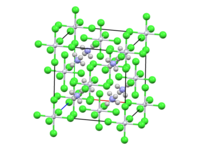
| ||||
| Kristala strukturo de la Amonia heksakloroplatenato | ||||

| ||||
| Kemia strukturo de la amonia heksakloroplatenato | ||||
| Kemia formulo | ||||
| CAS-numero-kodo | 16919-58-7 | |||
| ChemSpider kodo | 10628022 | |||
| PubChem-kodo | 24852087 | |||
| Fizikaj proprecoj | ||||
| Aspekto | flavaj aŭ oranĝo-ruĝecaj, senodoraj kristaloj | |||
| Molmaso | 443.873 g mol−1 | |||
| Smiles | [NH4+].[NH4+].Cl [Pt-2](Cl)(Cl)(Cl)(Cl)Cl | |||
| Denseco |
| |||
| Fandopunkto | 380 °C (716 ℉; 653 K) malkomponiĝas | |||
| Solvebleco:Akvo | ||||
| Mortiga dozo (LD50) | 195 mg/k | |||
| Sekurecaj Indikoj | ||||
| Sekureco | R25 R41 R42/43 | |||
| Risko | S22 S26 S36/37/39 S45 | |||
| Pridanĝeraj indikoj | ||||
| Danĝero
| ||||
| GHS etikedigo de kemiaĵoj | ||||
| GHS Damaĝo-piktogramo |
| |||
| GHS Signalvorto | Damaĝa substanco | |||
| GHS Deklaroj pri damaĝoj | H301, H317, H318, H334 | |||
| GHS Deklaroj pri antaŭgardoj | P261, P280, P301+310, P305+351+338, P342+311 | |||
(25 °C kaj 100 kPa) | ||||
Amonia heksakloroplatenato aŭ (NH4)2PtCl6 estas neorganika komponaĵo, rezultanta el reakcio inter la NH4Cl kaj "platena klorido", rara ekzemplo de solvebla salo el plateno, kiu ne estas higroskopa. Ĝi estigas intense flavajn solvaĵojn en akvo. En la ĉeesto de 1 M NH4Cl, ĝia solvebleco estas nur 2,8 x 10−3 g/100 ml. Amonia heksakloroplatenato uzatas en platena galvanizado; varmigo de amonia heksakloroplatenato sub kurento de hidrogeno ĉe 200 °C produktas platenan spongon. Traktado per kloro estigas H2PtCl6.
Historio
[redakti | redakti fonton]William Hyde Wollaston malkovris rodion en 1804, en kruda platena erco el Sudameriko kaj iom poste li malkovris alian elementon, la paladion. Li dissolvis la ercon en reĝa akvo[1], neŭtraligis la acidon kun natria hidroksido kaj precipitigis la platenon per traktado kun salmiako, kiel amonia heksakloroplatenato. Paladio estis tiam separita kiel "paladia cianido" pere de traktado kun "hidrarga cianido". La restanta materialo estis ruĝa substanco enhavanta "rodian kloridon" el kiu la metalo estis apartigita per reduktiĝo kun hidrogena gaso[2].
Reakcioj
[redakti | redakti fonton]- Sintezo de la amonia heksakloroplatenato pere de reakcio inter platena kvarklorido kaj amonia klorido:
- Interŝanĝa reakcion de la heksakloroplatenata acido kaj amonia klorido[3]:
- Malkomponiĝas ĉe varmigo:
- Ĝi reakcias kun alkalo diluita:
- Ĝi reakcias kun alkalo varmigita:
- Kune kun koncentrita solvaĵo de amonia hidroksido ĝi reakcias alimaniere:
- Ĝi reakcias kun sulfida acido:
- Reakcio inter la amonia heksakloroplatenato kaj formiata acido:
Literaturo
[redakti | redakti fonton]- Sigma Aldrich
- American Elements
- Proctor and Hughes' Chemical Hazards of the Workplace, Nick H. Proctor, James P. Hughes, Gloria J. Hathaway
- Mineral Processing Plant Design, Practice, and Control Proceedings, Andrew L. Mular, Doug N. Halbe, Derek John Barratt
- Handbook of Inorganic Compounds, Dale L. Perry
- Gravimetric Analysis: International Series of Monographs on ..., Volume 7, László Erdey
- Extractive Metallurgy of Nickel, Cobalt and Platinum Group Metals, Frank Kenneth Crundwell, Michael Moats, Venkoba Ramachandran
- Evaluation of Fertility by Plant and Soil Analysis, Volume 1, David Davidescu, Velicica Davidescu
- Handbook of Preparative Inorganic Chemistry, Volume 2, Georg Brauer
- Materials Handbook: A Concise Desktop Reference, François Cardarelli
| ||||||
Referencoj
[redakti | redakti fonton]- ↑ Reĝa akvo estas miksaĵo de unu parto de nitrata acido kun tri partoj de klorida acido.
- ↑ Materials Handbook: A Concise Desktop Reference, François Cardarelli
- ↑ Chemistry Vol (1 and 2). Arkivita el la originalo je 2016-03-05. Alirita 2015-07-28 .
- ↑ The Esoteric Codex: Alchemy I, Mark Rogers









![{\displaystyle {\mathsf {PtCl_{4}+2NH_{4}Cl\ {\xrightarrow {}}\ (NH_{4})_{2}[PtCl_{6}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6489f975cd8f3edd0b89f595ea580be3479a1248)
![{\displaystyle {\mathsf {H_{2}[PtCl_{6}]+2NH_{4}Cl\ {\xrightarrow {}}\ (NH_{4})_{2}[PtCl_{6}]\downarrow +2HCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/953938d8db4d393e05d9b34232dbe67c03899b28)
![{\displaystyle {\mathsf {(NH_{4})_{2}[PtCl_{6}]\ {\xrightarrow {215-350^{o}C}}\ Pt+2NH_{4}Cl+2Cl_{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/954c19082ab3ed8462b0b3da9fdacd4c8d3312f4)
![{\displaystyle {\mathsf {3(NH_{4})_{2}[PtCl_{6}]\ {\xrightarrow {350-600^{o}C}}\ 3Pt+2NH_{4}Cl+16HCl+2N_{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/530446ba3d1b03176b198a00792805265bcfbb05)
![{\displaystyle {\mathsf {(NH_{4})_{2}[PtCl_{6}]+4NaOH\ {\xrightarrow {}}\ PtO_{2}\downarrow +6NH_{4}Cl+4NaCl+2H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/65d3ff987afd6af93021fa30f4d3432b14e79427)
![{\displaystyle {\mathsf {(NH_{4})_{2}[PtCl_{6}]+2\;NaOH\ {\xrightarrow {100^{o}C}}\ (NH_{4})_{2}[Pt(OH)_{6}]\downarrow +6NaCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eb36e58ce29aa6da7f080dcce360182a3b56505c)
![{\displaystyle {\mathsf {(NH_{4})_{2}[PtCl_{6}]+2\;(NH_{3}\cdot H_{2}O)\ {\xrightarrow {}}\ [Pt(NH_{3})_{2}Cl_{4}]\downarrow +2\;NH_{4}Cl+2\;H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d30fed0644509a8450c6729445c964eae05f4b41)
![{\displaystyle {\mathsf {(NH_{4})_{2}[PtCl_{6}]+2H_{2}S\ {\xrightarrow {}}\ PtS_{2}\downarrow +2NH_{4}Cl+4HCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4aa5dce46d9ad58767d04d91e8a3fc022949623a)
![{\displaystyle {\mathsf {(NH_{4})_{2}[PtCl_{6}]+2HCOOH\ \xrightarrow {\tau } \ Pt\downarrow +2CO_{2}\uparrow +2NH_{4}Cl+4HCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b8cc8e490e8d0668c2a79ce1bae7b2a9d8b5f0dd)
