El Vikipedio, la libera enciklopedio
Natria germaniumato
Kemia strukturo de la
Kemia strukturo de la
Alternativa(j) nomo(j)
Germaniumato de natrio
Kemia formulo Na2 GeO3 (meta)Na4 GeO4 (orto)
CAS-numero-kodo 12025-19-3
ChemSpider kodo 11214192
PubChem-kodo 13783481
Fizikaj proprecoj
Aspekto blankaj senodoraj kristaloj
Molmaso 166,62 g mol−1
Smiles [O-][Ge](=O)[O-].[Na+].[Na+]
Denseco 3,31 g/cm3
Refrakta indico
n
761
20
{\displaystyle n_{761}^{20}}
1,59
Fandopunkto 1,060 °C (1,940 ℉ ; 1,330 K)
Solvebleco
Akvo :14.4 g/100 mL (0 °C )23.8 g/100 mL (25 °C )
132 (83.5 °C )
GHS etikedigo de kemiaĵoj [ 1]
GHS Damaĝo-piktogramo
GHS Signalvorto Averto
GHS Deklaroj pri damaĝoj H315 , H319 , H335
GHS Deklaroj pri antaŭgardoj P261 , P264 , P271 , P280 , P302+352 , P332+313 , P304+340 , P305+351+338 , P337+313 , P312 , P321 , P403+233 , P405 , P501
Escepte kiam indikitaj, datumoj estas prezentataj laŭ iliaj normaj kondiĉoj pri temperaturo kaj premo25 °C kaj 100 kPa)
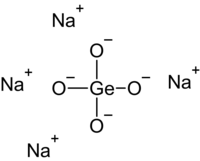
Natria germaniumato , germaniumato de natrio aŭ Na2 GeO3 germaniumo kaj natrio , blanka salo preparita per fando de germaniuma oksido kaj natria oksido sub altaj temperaturoj. Ĝi estas disponebla en du formoj: natria meta-germaniumato aŭ Na2 GeO3 kaj natria orto-germaniumato aŭ Na4 GeO4 .
Natria germaniumato enhavas polimerajn anjonojn GeO3 2− konsistantaj je kvaredra kundividantaj verticoj. Germaniumato de natrio ĉefe uzatas por sintezo de aliaj germaniumaj kombinaĵoj.
Fando de germaniuma oksido kaj natria oksido:
G
e
O
2
+
N
a
2
O
→
T
N
a
2
G
e
O
3
{\displaystyle ~{\mathsf {GeO_{2}+Na_{2}O\ {\xrightarrow {T}}\ Na_{2}GeO_{3}}}}
G
e
O
2
+
N
a
2
C
O
3
→
1200
o
C
N
a
2
G
e
O
3
+
C
O
2
↑
{\displaystyle ~{\mathsf {GeO_{2}+Na_{2}CO_{3}\ {\xrightarrow {1200^{o}C}}\ Na_{2}GeO_{3}+CO_{2}\uparrow }}}
G
e
O
2
+
2
N
a
O
H
→
T
N
a
2
G
e
O
3
+
H
2
O
{\displaystyle ~{\mathsf {GeO_{2}+2\;NaOH\ {\xrightarrow {T}}\ Na_{2}GeO_{3}+H_{2}O}}}
G
e
+
2
H
2
O
2
+
2
N
a
O
H
→
N
a
2
G
e
O
3
+
3
H
2
O
{\displaystyle ~{\mathsf {Ge+2\;H_{2}O_{2}+2NaOH\ {\xrightarrow {}}\ Na_{2}GeO_{3}+3\;H_{2}O}}}
La anhidra kristala salo prepariĝas per heitado:
N
a
2
G
e
O
3
⋅
7
H
2
O
→
300
o
C
N
a
2
G
e
O
3
+
7
H
2
O
↑
{\displaystyle ~{\mathsf {Na_{2}GeO_{3}\cdot 7H_{2}O\ {\xrightarrow {300^{o}C}}\ Na_{2}GeO_{3}+7H_{2}O\uparrow }}}
La akvaj solvaĵoj estas alkalaj pro hidrolizo de la anjono:
G
e
O
3
2
−
+
H
2
O
⇄
H
G
e
O
3
−
+
O
H
−
{\displaystyle ~{\mathsf {GeO_{3}^{2-}+H_{2}O\ \rightleftarrows \ HGeO_{3}^{-}+OH^{-}}}}
N
a
2
G
e
O
3
+
6
H
C
l
→
N
a
2
[
G
e
C
l
6
]
+
3
H
2
O
{\displaystyle ~{\mathsf {Na_{2}GeO_{3}+6\,HCl\ {\xrightarrow {}}\ Na_{2}[GeCl_{6}]+3\,H_{2}O}}}
Ĝi malkomponiĝas per traktado kun diluitaj acidoj:
N
a
2
G
e
O
3
+
2
H
N
O
3
→
G
e
O
2
↓
+
2
N
a
N
O
3
+
H
2
O
{\displaystyle ~{\mathsf {Na_{2}GeO_{3}+2\;HNO_{3}\ {\xrightarrow {}}\ GeO_{2}\downarrow +2\;NaNO_{3}+H_{2}O}}}
N
a
2
G
e
O
3
+
3
H
2
O
→
N
a
O
H
N
a
2
[
G
e
(
O
H
)
6
]
{\displaystyle ~{\mathsf {Na_{2}GeO_{3}+3\,H_{2}O\ {\xrightarrow {NaOH}}\ Na_{2}[Ge(OH)_{6}]}}}










![{\displaystyle ~{\mathsf {Na_{2}GeO_{3}+6\,HCl\ {\xrightarrow {}}\ Na_{2}[GeCl_{6}]+3\,H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ab43bba6f800b0bf9c6ffca0848f398c10cfb4e7)

![{\displaystyle ~{\mathsf {Na_{2}GeO_{3}+3\,H_{2}O\ {\xrightarrow {NaOH}}\ Na_{2}[Ge(OH)_{6}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d95442f7e6858ee07c551ea8fb1e9617de954efe)
