Natria acetato
| Natria acetato | ||

| ||
| Kemia strukturo de la Natria acetato | ||

| ||
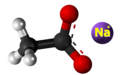
| 3D Kemia strukturo de la Natria acetato | ||

| ||
| Kristaloj de natria acetato | ||
| Alternativa(j) nomo(j) | ||
| ||
| Kemia formulo | ||
| CAS-numero-kodo | ||
| ChemSpider kodo | 29105 | |
| PubChem-kodo | 517045 | |
| Fizikaj proprecoj | ||
| Aspekto | Blanka delikveska pulvoro, higroskopa | |
| Molmaso | 82.0343 g mol−1 | |
| Denseco | 1.528 (20 °C, anhidra) g/cm3 | |
| Refrakta indico | 1,464 | |
| Fandopunkto | ||
| Bolpunkto | ||
| Solvebleco | ||
| Acideco (pKa) | 24 (20 °C) 4.76 en acetato | |
| Mortiga dozo (LD50) | 3530 mg/kg (muso, buŝa) | |
| Ekflama temperaturo | >250 °C (482 ℉; 523 K) °C | |
| Memsparka temperaturo | 607 °C | |
| Sekureco | S22 S24/25 | |
| Pridanĝeraj indikoj | ||
| Danĝero
| ||
| GHS etikedigo de kemiaĵoj | ||
| GHS Damaĝo-piktogramo |
| |
| GHS Signalvorto | Averto | |
| GHS Deklaroj pri damaĝoj | H303, H316, H319, H320, H333 | |
| GHS Deklaroj pri antaŭgardoj | P264, P280, P302+352, P304+340, P305+351+338, P337+313 | |
(25 °C kaj 100 kPa) | ||
Natria acetato, acetato de natrio aŭ H3C-COO-Na estas neorganika natria salo de acetata acido. Ĉi-senkolora delikveska substanco posedas grandan gramon da uzo. En media temperaturo ĝi prezentiĝas kiel kristala solido unuklina kaj higroskopa, senkolora, senodora, solvebla en akvo kaj parte solvebla en etanolo.
Sintezoj
[redakti | redakti fonton]Sintezo 1
[redakti | redakti fonton]- Preparado per agado de acetata acido kaj natria hidroksido:
Sintezo 2
[redakti | redakti fonton]- Preparado per traktado de acetata anhidrido kaj natria hidroksido:
Sintezo 3
[redakti | redakti fonton]- Preparado per reakcio de acetata acido kaj natria karbonato:
Sintezo 4
[redakti | redakti fonton]- Preparado per traktado de natria etoksido kaj etila acetato:
Sintezo 5
[redakti | redakti fonton]- Preparado per interagado de alila acetato kaj natria formiato:
Sintezo 6
[redakti | redakti fonton]- Preparado per acida transesterigo inter acetata acido kaj natria formiato:
Sintezo 7
[redakti | redakti fonton]- Preparado per alkohola transesterigo inter alila acetato kaj natria hidroksido:
Reakcioj
[redakti | redakti fonton]Reakcio 1
[redakti | redakti fonton]- Hidrolizo de la natria acetato:
Reakcio 2
[redakti | redakti fonton]- Reakcio kun sulfata acido:
Reakcio 3
[redakti | redakti fonton]- Reakcio per acida transesterigo kun formiata acido:
Reakcio 4
[redakti | redakti fonton]- Reakcio per alkohola transesterigo kun vinila alkoholo:
Reakcio 5
[redakti | redakti fonton]- Reduktigo de la natria acetato:
Reakcio 6
[redakti | redakti fonton]- Reakcio kun NH3:
Reakcio 7
[redakti | redakti fonton]- Reakcio kun HCl:
Uzoj
[redakti | redakti fonton]Natria acetato uzatas en tekstila industrio por neŭtraligo de reziduaj kurentoj da sulfata acido kaj kiel fotorezista kiam uzatas kolorigiloj surbaze de anilino. Ankaŭ oni uzas kiel tanadagento en la traktado per kromio. Ĝi helpas malakceli la vulkaniza procezo de la kloropreno en la sinteza produktado de kaŭĉuko.
Ĝi estas kemiaĵo uzata por gustigi la frititajn terpomojn. Kutime oni aldonas ĝin al nutraĵoj kiel konservanto, en ĉi-kazoĝi identiĝas kiel natria duacetato kaj ĝia internacia kodo estas E262I.
Kiel konjuga bazo de malforta acido, iu solvaĵo de natria acetato kaj acetata acido povas agi kiel bufro-solvaĵo por relativa konservado de la pH. Ĉi tio estas aparte utila en biokemio, kie la reakcioj dependas de la pH.
Same ĝi uzatas en termosakoj memaktivaj, konata kiel "varma glacio". Kiam trihidrataj kristaloj de acetato de natrio varmiĝas (fandopunkto 58 °C), en saturita solvaĵo de tiu substanco, la troaj kristaloj fandiĝos ĉirkaŭ 100 °C. Kiam ĉi-procezo malvarmiĝas, oni estiĝas supersaturita dissolvaĵo de natria acetato en akvo. Ĉi-solvaĵo kapablas malvarmiĝi ĉe meditemperaturo, t. e., malsuper ol ĝia fandopunkto, sen formado de kristaloj. Kiam metala disko premiĝas en la interno de la termosako, iu centro de aglomerigo kaŭzas la kristaliĝon de la dissolvaĵo en solida acetato de natrio.
Reakcioj
[redakti | redakti fonton]- La etila estero de acetata acido estigas per reakcio de natria acetato kaj bromoetilo:
H3C-COO− Na+ + Br-CH2-CH3 → H3C-COO-CH2-CH3+ NaBr
- Natria acetato malkomponiĝas en natria karbonato kaj acetono:
2CH3COONa → Na2CO3 + CH3COCH3
Literaturo
[redakti | redakti fonton]- Sigma Aldrich
- Steve Spangler Science
- About education
- Chemical Book
- Remington: The Science and Practice of Pharmacy, David B. Troy, Paul Beringer
- Fluids and Electrolytes in the Surgical Patient, Volume 476, Carlos Pestana
- Essential Laboratory Mathematics: Concepts and Applications for the Chemical ..., Catherine W. Johnson (MAed/Math.), Catherine W. Johnson, Daniel L. Timmons, Pamela E. Hall
- Chemical Demonstrations: A Handbook for Teachers of Chemistry, Volume 1[rompita ligilo], Bassam Z. Shakhashiri
- Essentials of Organic Chemistry: For Students of Pharmacy, Medicinal ..., Paul M. Dewick
| ||||||
| ||||||






![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a133815724e6bf6cfb39eb43f1e6c1d96ea8d17)





![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{2[H]}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3e0bf23d773dd68c0756bf7219ac82b7a51e73c6)


