Natria cianato
| Natria cianato | ||
| ||
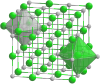
| Bastona Kemia strukturo de la natria cianato | ||

| ||
| 3D Kemia strukturo de la natria cianato | ||
| Alternativa(j) nomo(j) | ||
| ||
| CAS-numero-kodo | 917-61-3 | |
| ChemSpider kodo | 12922 | |
| PubChem-kodo | 517096 | |
| Fizikaj proprecoj | ||
| Aspekto | Blanka kristala solido, senodora | |
| Molmaso | 65,01 g mol−1 | |
| Smiles | C(#N)[O-].[Na+] | |
| Denseco | 1,893 g/cm3 | |
| Fandopunkto | 550 °C (1,022 ℉; 823 K) | |
| Solvebleco | ||
| Nesolvebleco | ||
| Mortiga dozo (LD50) | 1500 mg/kg (muso, buŝa) | |
| Sekurecaj Indikoj | ||
| Risko | R22 R52/53 | |
| Sekureco | S2 S24/25 S61 | |
| Pridanĝeraj indikoj | ||
| Danĝero
| ||
| GHS etikedigo de kemiaĵoj[1] | ||
| GHS Damaĝo-piktogramo |
| |
| GHS Signalvorto | Averto | |
| GHS Deklaroj pri damaĝoj | H302, H412 | |
| GHS Deklaroj pri antaŭgardoj | P273 | |
(25 °C kaj 100 kPa) | ||
Natria cianato, cianato de natrio aŭ NaOC≡N estas neorganika kombinaĵo, blanka solido kun kristala strukturo korpo-centrita, romboedra krado, en meditemperaturo. Ĝi estas salo el cianata acido[2] kaj natria hidroksido, ideala nukleofilo, kiu ĉefe kontribuas por la stereospecifeco en certaj reakcioj samkiel la produktado de la kirala[3] okzazolidono[4].
Sintezoj
[redakti | redakti fonton]Sintezo 1
[redakti | redakti fonton]- Reakcio inter ureo kaj natria karbonato[5]:
Sintezo 2
[redakti | redakti fonton]- Reakcio inter natria cianido kaj oksigeno:
Sintezo 3
[redakti | redakti fonton]- Reakcio inter "cianogena bromido" kaj natria hidroksido:
Sintezo 4
[redakti | redakti fonton]- Super 140 °C, ureo malkomponiĝas en cianatan acidon kaj amoniakon, kiu reakciante kun natria hidroksido donas natrian cianaton:
Sintezo 5
[redakti | redakti fonton]- Kiam ureo fandiĝas kun natria karbonato, natria cianato, karbona duoksido, amoniako kaj akvo estiĝas:
Sintezo 6
[redakti | redakti fonton]- * Reakcio inter ureo kaj natria karbonato::
Reakcioj
[redakti | redakti fonton]Reakcio 1
[redakti | redakti fonton]- Cianata acido reakcias kun ureo por estigi biureton:[6]
Reakcio 2
[redakti | redakti fonton]- Cianata acido reakcias kun akvo por estigi amoniakon kaj "karbonan duoksidon":
Reakcio 3
[redakti | redakti fonton]Reakcio 4
[redakti | redakti fonton]- * Kiel ĉiuj alkalo-metalaj cianatoj kaj amoniako, natria cianato iom post iom hidroliĝas al natria karbonato, karbona duoksido kaj amoniako::
Reakcio 5
[redakti | redakti fonton]- Natria cianato reakcias kun fortaj acidoj estigante natriajn kaj amoniajn salojn de la respektiva acido::
Reakcio 6
[redakti | redakti fonton]- Karbona unuoksido oksidiĝas al karbona duoksido en la ĉeesto de natria cianato:
Reakcio 7
[redakti | redakti fonton]- Natria cianato oksidas karbonon al karbona duoksido kaj karbona unuoksido:
Medicinaj aplikoj
[redakti | redakti fonton]Natria cianato estas utila reakcianto en produktado de asimetria ureo kiu havas rangon de biologia aktiveco ĉefe en arilaj izocianataj perantoj. Tiaj perantoj samkiel natria cianato uzatas en medicino por kontraŭstari la kancerogenajn efektojn en la korpo, eble helpante personojn kun serpoĉela anemio kaj blokante certajn akceptantojn por melanino kiu laŭŝajne helpas en kazoj de dikeco. Plejofte la perantoj produktitaj kun natria cianido estas uzataj por medicinaj studoj, tamen, en kazoj de serpoĉela anemio kaj esploroj pri anti-kancerogenaĵoj, natria cianato propradire estas la ĉefa kombinaĵo de intereso.
Literaturo
[redakti | redakti fonton]- Sigma Aldrich
- Erric Industries
- ChemicalLand21
- Chemical Book
- Science Direct
- Concise Encyclopedia Chemistry, Mary Eagleson
- Practical Nitriding and Ferritic Nitrocarburizing, David Pye
- Handbook of Heat Treatment of Steels, K. H. Prabhudev
| ||||||
Referencoj
[redakti | redakti fonton]- ↑ Sigma aldrich
- ↑ Cianata acido estas izomero de la fulminata acido aŭ H-C≡N→O
- ↑ Kiraleco estas nesimetria speguligo de iu kemia substanco.
- ↑ Polymer Syntheses, Volume 1, Stanley Sandler
- ↑ CO2 Chemistry
- ↑ The Chemistry of Urea, the Theory of Its Constitution, and of the Origin and Mode of Its Formation in Living Organisms





![{\displaystyle {\mathsf {{\xrightarrow[{}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/af21b07e9e503bdbbee6814c136975f68f374663)

![{\displaystyle {\mathsf {{\xrightarrow[{-NH_{3}}]{140^{o}C}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/18e2bec64661750e4aba601e85228e63f78029e0)
![{\displaystyle {\mathsf {{\xrightarrow[{-H_{2}O}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f43b576bd9ed502188c0c051352bf946467a579c)