Kalia fluoroacetato
| Kalia fluoroetanato | |||
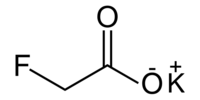 | |||
| Plata kemia strukturo de la Kalia fluoroacetato | |||
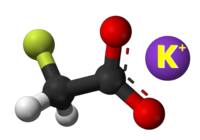 | |||
| Tridimensia kemia strukturo de la Kalia fluoroacetato | |||
 | |||
| Kalia fluoroacetato trovatas en la folioj de la Dichapetalum cymosum. | |||
| Alternativa(j) nomo(j) | |||
| |||
| Kemia formulo | |||
| CAS-numero-kodo | 23745-86-0 | ||
| ChemSpider kodo | 11595903 | ||
| PubChem-kodo | 5236 | ||
| Merck Index | 15,4199 | ||
| Fizikaj proprecoj | |||
| Aspekto | blanka senodora pulvoro | ||
| Molmaso | 116.1327832 g·mol−1 | ||
| Solvebleco | Akvo:Tute solvebla | ||
| Mortiga dozo (LD50) | 4.68 mg/kg (buŝe) | ||
| GHS etikedigo de kemiaĵoj | |||
| GHS Damaĝo-piktogramo |
| ||
| GHS Signalvorto | Damaĝo | ||
| GHS Deklaroj pri damaĝoj | H300, H310, H330, H400 | ||
| GHS Deklaroj pri antaŭgardoj | P260, P262, P264, P270, P271, P273, P280, P284, P301+310, P304+340, P310, P320, P321, P330, P361, P363, P391, P403+233, P405, P501 | ||
(25 °C kaj 100 kPa) | |||
Kalia fluoroacetato estas kalia organika salo de la fluoroacetata acido, blanka senodora substanco tre toksa kaj uzata kiel pesticido, raticido, nature trovata en plantoj aŭ sinteze produktitaj en laboratorioj. Kalia unufluoroacetato estis izolita en la foliaro de la Dichapetalum cymosum, sudafrika planto, kaj estis la unua konata specimeno de nature okazanta organika fluorido.
La planto, loke konata kiel "Gifblaar" kaŭzis la mortojn de multaj bovoj kaj estis agnoskita de Eŭropanoj kiel venenohava ĉirkaŭ 1890. Ekde tiam, fluoroacetataj kombinaĵoj estis izolitaj ekde venenaj plantoj en Aŭstralio ("Acacia georginae", "Gastrolobium spp."), Brazilo (Mariĥuano, Palicourea margravii, kaj Afriko ("Dichapetalum spp."). "Dichapetalum toxicarium" estas tre konata planto en Orienta Afriko, konata pro ĝia venenaĵo, pli malfrue identigita kiel fluoroacetato, kiu estas mortiga al ratoj.[1][2]
Estas bone konata ke la foliaro de la dichapetalum cymosum perdas ĝian toksecon kaj fluoroacetaton kiam ili iĝas maljunaj.[3] Kalia fluoroacetato estas tre solvebla en akvo. La rezultaj solvaĵoj enhavas milde koncentritajn hidroksilajn jonojn kaj pH pli granda ol 7. Ili reakcias kiel bazoj kaj neŭtraligas acidojn. Ĉi-neŭtraligaj reakcioj generas varmon sed malpli ol tiuj generitaj de reakciemaj bazoj el la grupo 10 kaj tiuj neŭtraligoj de aminoj.
Fluoroacetatoj ne reakcias kiel oksidigaj agentoj aŭ reduktagentoj, tamen, tiaj kondutoj ne estas neeblaj. Fluoroacetatoj estas alte toksa al mamuloj kaj insektoj sed la saloj de la trifluoroacetata acido estas multe malpli toksaj. Ĝi estas nebrulema substanco sed ĝi povas malkomponiĝi sub varmigado estigante korodajn kaj toksajn fumojn. Ĝiaj ujoj povas eksplodi kiam varmigitaj. Elfluado de fluoracetato povas polui akvovojoj.
Sintezoj
[redakti | redakti fonton]Sintezo 1
[redakti | redakti fonton]- Kalia fluoroacetato estas preparata per agado de la kalia kloroacetato sur natria fluorido:
 |
Sintezo 2
[redakti | redakti fonton]- Ĝi same sintezeblas per reakcio de fluoroacetata acido kaj kalia hidroksido:
Literaturo
[redakti | redakti fonton]- Chemical Book
- 1080Science
- Carbon-Fluorine Compounds: Chemistry, Biochemistry and Biological Activites, CIBA Foundation Symposium
- ADR Dangerous Goods
- Signs 4 Safety[rompita ligilo]
- Potassium fluoride removal from potassium chloride
Vidu ankaŭ
[redakti | redakti fonton]- Frédéric Swarts (1866-1940)
- Etila fluoroacetato
- Metila fluoracetato
- Etila bromoacetato
- Metila bromoacetato
- Metila jodoacetato
- Etila jodoacetato
Referencoj
[redakti | redakti fonton]- ↑ Eisler's Encyclopedia of Environmentally Hazardous Priority Chemicals, Ronald Eisler
- ↑ Symptomatology and Therapy of Toxicological Emergencies, William B. Deichmann, Horace W. Gerarde
- ↑ Badenhuizen kaj Slinger, 1954
| ||||||






